
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。有关原溶液中下列说法不正确的是:
| A.至少存在4种离子 |
| B.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C.SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 |
| D.CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
C
解析试题分析:解此类题要注意注意:①互斥性原则:依据题给条件,确定某种离子一定存在,凡是与该离子不能大量共存的,一定不能存在;②进出性原则:加入某种试剂引进原溶液中可能存在的离子,会干扰原溶液中可能存在离子的检验;③电中性原则:溶液不带电,阴离子所带的正电荷数等于阴离子所带的负电荷数;依题意知,原溶液加入过量NaOH溶液,加热,得到0.02mol气体,说明一定有NH4+,且物质的量为0.02mol;同时产生红褐色沉淀氢氧化铁,说明一定有Fe3+,过滤,洗涤,灼烧,得到1.6g固体为氧化铁,物质的量为0.01mol,故有0.02molFe3+,根据互斥性原则,溶液中一定没有CO32-; 向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀,为硫酸钡,一定有SO42-,物质的量为0.02mol; 根据电中性原则,溶液中一定有Cl-,物质的量浓度至少0.4mol/L,A、由上述分析知,原溶液中至少存在Cl-、SO42-、NH4+、Fe3+四种离子,正确;B、根据电荷守恒,至少存在0.04molCl-,且c(Cl-)≥0.4mol/L,正确;C、原溶液一定存在氯离子,错误;D、由上述分析知,CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在,正确。
考点:考查离子推断和离子推断。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:单选题
把Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO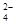 全部转化成BaSO4沉淀,此时铝元素的存在形式是
全部转化成BaSO4沉淀,此时铝元素的存在形式是
A.Al | B.Al(OH)3 | C.AlO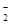 | D.Al 和Al(OH)3 和Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )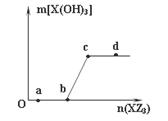
| A.d点对应的溶液中:K+、NH4+、CO32-、I- |
| B.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+ |
| C.b点对应的溶液中:Na+、S2-、SO42-、Cl- |
| D.a点对应的溶液中:Na+、K+、S042-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各离子组在溶液中能共存且通入括号中相应气体后,仍能大量存在的是
| A.Na+、Ba2+、HSO3-、I-(氯气) |
| B.Ca2+、NO3-、Na+、Cl-(二氧化硫) |
| C.Fe3+、SO42-、CO32-、NO3- (氨气) |
| D.Na+、K+、HCO3-、Cl-(二氧化碳) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某无色溶液中可能含有①Na+ ②Ba2+ ③Cl- ④Br- ⑤SO32- ⑥SO42-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤序号 | 操 作 步 骤 | 现 象 |
| (1) | 用pH试纸检验 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加入CCl4、振荡、静置 | 下层呈橙色 |
| (3) | 向(2)所得水溶液加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
| A.d点溶液中含有的溶质只有Na2SO4 |
| B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓ |
| C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+ |
| D.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe2+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0. 02 mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6 g红棕色固体;向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在4种离子 |
| B.Cl– 一定存在,且c(Cl )≥0.4 mol/L |
| C.SO42–、NH4+,一定存在,Cl–可能不存在 |
| D.CO32–、Al3+ 一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
解释下列现象的离子方程式不正确的是
| A.铁溶于稀硝酸,溶液变黄: 3 Fe +8H+ +2NO3-="3" Fe2++2NO+4H2O |
| B.FeBr2与Cl2物质的量之比为1∶1时:2Fe2++2Br-+2Cl2=2Fe3++4C1-+Br2 |
| C.向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:A13++2SO42-+2Ba2++4OH-=2BaSO4↓+A1O2-+2H2O |
| D.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3C1O-+3H2O=Fe(OH)3↓+3HC1O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式书写正确是
| A.向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3—+OH-=CaCO3↓+H2O |
| B.将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓ |
| C.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D.氯化亚铁溶液中加入稀硝酸:9Fe2++4H++NO3-=9Fe3++2H2O+NO↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com