
分析 硫酸铁为强电解质,完全电离生成三价铁离子与硫酸根离子;
依据硫酸铁电离方程式可知:1mol硫酸铁电离产生2mol三价铁离子和3mol硫酸根离子,据此计算三价铁离子与硫酸根离子浓度.
解答 解:硫酸铁为强电解质,完全电离生成三价铁离子与硫酸根离子,电离方程式:Fe2(SO4)3=2Fe3++3SO42-,
由硫酸铁电离方程式Fe2(SO4)3=2Fe3++3SO42-,可知1mol硫酸铁电离产生2mol三价铁离子和3mol硫酸根离子,所以硫酸铁溶液中c(Fe3+)=2c(Fe2(SO4)3)=2×3mol/L=6mol/L;
硫酸铁溶液中c(SO42-)=3c(Fe2(SO4)3)=3×3mol/L=9mol/L;
答:电离方程式为Fe2(SO4)3=2Fe3++3SO42-;c(Fe3+)=6mol/L、c(SO42-)=9mol/L.
点评 本题考查了电解质电离方程式书写及溶液中离子浓度计算,明确电解质强弱是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
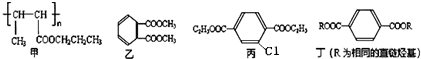
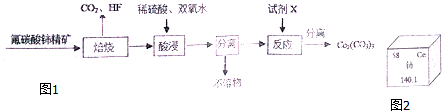
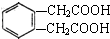 ;
;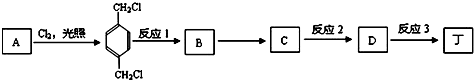
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只显红色 | B. | 呈无色 | C. | 无色或蓝色 | D. | 红色或无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化钠 | B. | 浓盐酸 | C. | 水 | D. | 硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是反应物的浓度、压强、温度、催化剂等 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸的起始温度.NaOH溶液的起始温度和反应后反应体系的最高温度 | |
| C. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 | |
| D. | 某可逆反应的化学平衡常数K,只随温度的改变而改变,且温度越高K值一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质中都只含C、H、O三种元素 | |
| B. | 糖类、油脂、蛋白质都能发生水解反应 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉、纤维素分子组成都可表示为(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com