
分析 (1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气;
(2)NH4NO3分解,一种可能是发生复分解反应,还有一种可能是氧化还原反应,根据氧化还原反应中有元素化合价升高就必须有元素化合价降低的原则进行判断;
(3)①结合原子守恒分析X的化学式;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2;
(4)①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2),原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,据此计算.
解答 解:(1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气,则钠、钾着火,可用细沙盖灭来灭火,故答案为:D;
(2)NH4NO3分解,一种可能是发生复分解反应,还有一种可能是氧化还原反应,根据氧化还原反应中有元素化合价升高就必须有元素化合价降低的原则进行判断:
A、NH4NO3→N2+O2+H2O中N从+5价降为0价,N从-3升为0价,O从-2升为0价,符合氧化还原反应的特征,故正确;
B、NH4NO3→NH3+HNO3满足复分解反应的条件,故正确;
C、NH4NO3→O2+HNO3+H2O中只有化合价升高的,没有化合价降低的,故错误;
D、NH4NO3→N2+HNO3+H2O中N从+5价降为0价,N从-3升为0价,符合氧化还原反应的特征,故正确;
E、NH4NO3→N2+NH3+H2O中虽然N从+5价降为0价,N从-3升为0价,但由于每个N升高的数值小于降低的数值,即消耗的铵根的物质的量要比硝酸根离子多,所以不可能有NH3产生,故错误;
F、NH4NO3→N2O+H2O中N从+5价降为+1价,N从-3升为+1价,符合氧化还原反应的特征,故正确;
故答案为:A、B、D、F;
(3)①NaCN+H2O2--N2↑+X+H2O中,由原子守恒可知X为NaHCO3,故答案为:NaHCO3;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,
故答案为:B;
(4)①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为$\frac{1.408g}{44g/mol}$=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为$\frac{0.032mol}{0.04mol}$×100%=80%,
故答案为:80%.
点评 本题考查氧化还原反应的计算及含量测定等,综合性较强,注重高频考点的考查,侧重分析与计算能力的考查,注意反应中元素的化合价变化,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 吸热反应在一定条件(如常温、加热等)也能发生 | |
| C. | 放热反应都不需要加热就能发生 | |
| D. | 化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | 32g | C. | 38.4g | D. | 48g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸不是分散系 | |
| B. | 一种分散系里只有分散质和分散剂两种物质 | |
| C. | 分散剂一定是液体 | |
| D. | 按分散质和分散剂的状态(气、液、固)有9种组合方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| B. | Z和W在该条件下都不为气态 | |
| C. | 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 | |
| D. | 若该反应只在某温度T0以上才能进行,则该反应的平衡常数K随温度升高而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | B. | Cl-的结构示意图: | ||
| C. | H2O的电子式: | D. | H2O的电离方程式:H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
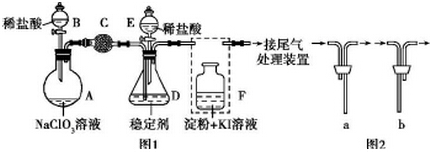
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com