
����Ŀ��ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ������������ͼ��ʾװ�ý����й�ʵ�飺 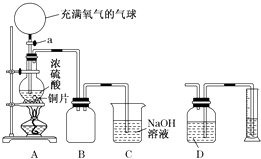
��1���ȹرջ���a����6.4gͭƬ��10mL 18mol/L��Ũ�������Բ����ƿ�й�������Ӧ��ɣ�������ƿ�л���ͭƬʣ�࣮�ٴ���a���������е�������������Բ����ƿ�����ͭƬ��ȫ��ʧ�� ��д������������Բ����ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽ��
����a֮ǰ��
����a֮�� ��
��B�������ռ�ʵ���в����������װ�ã�������ƿ�ڵĵ���δ��ȫ����ֱ����ͼ�ϰѵ��ܲ���������
��2��ʵ���ϣ��ڴ���a֮ǰ��������ʣ�࣮Ϊ�����ⶨ��������ʵ������ס�����ѧ��������������ƣ� �ټ�ѧ����Ƶķ����ǣ��Ȳⶨͭ��Ũ���ᷴӦ����SO2��������ͨ������ȷ����������ʵ��������ⶨSO2�ķ����ǽ�װ��A���������建��ͨ��װ��D���Ӷ����װ��A��������������������ɱ�״���£�������Ϊ��ѧ����Ƶ�ʵ�鷽����Dװ���е��Լ�Ϊ���ѧʽ����
����ѧ����Ƶķ����ǣ�����Ӧ�����Һ��ȴ��ȫ�����뵽�ձ���ϡ�ͣ�������ȷ��������100mL��Һ����ȡ20mL����ƿ�У�����ָʾ�����ñ�����������Һ���еζ�[��֪��Cu��OH��2��ʼ������pHԼΪ5]��ѡ���ָʾ��������Ϊ���������������ʵ���������ȥa mol/L����������Һb mL����ԭ��������ʵ���Ϊmol���ú�a��b�ı���ʽ����ʾ����
���𰸡�
��1��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��2Cu+2H2SO4+O2=2CuSO4+2H2O
CuSO4+SO2��+2H2O��2Cu+2H2SO4+O2=2CuSO4+2H2O
��2������NaHSO3�����ȣ�Cu��OH��2��ʼ������pHԼΪ5�����÷�̪��ָʾ��ʱ��Һ�е�Cu2+���NaOH��Ӧ��Cu��OH��2����ɫ����ŵζ��յ����ȷ�жϣ�![]()
���������⣺��1���ٴ���a֮ǰ��Ũ�����Cu�ڼ��������·���������ԭ��Ӧ����CuSO4��SO2��H2O����Ӧ����ʽΪCu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O������a��Cu��O2��ϡ���ᷴӦ����CuSO4��H2O����Ӧ����ʽΪ2Cu+2H2SO4+O2=2CuSO4+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O������a��Cu��O2��ϡ���ᷴӦ����CuSO4��H2O����Ӧ����ʽΪ2Cu+2H2SO4+O2=2CuSO4+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��2Cu+2H2SO4+O2=2CuSO4+2H2O����ͭ��Ũ���ᷴӦ�����˶����������壬���������ܶȱȿ��������������������ռ�������װ���еĵ�����Ӧ�����̳���װ��ͼΪ
CuSO4+SO2��+2H2O��2Cu+2H2SO4+O2=2CuSO4+2H2O����ͭ��Ũ���ᷴӦ�����˶����������壬���������ܶȱȿ��������������������ռ�������װ���еĵ�����Ӧ�����̳���װ��ͼΪ ![]() �����Դ��ǣ�
�����Դ��ǣ�  ����2���ٲⶨSO2��������ȷ�ⶨ��������ģ�����ˮ���ⶨװ��A��������������ʵ�鷽����Dװ���е��Լ�Ӧ���㲻��Ӧ���������ܽ�ȶȽ�С�����������ڱ���NaHSO3��Һ�е��ܽ�Ƚ��ͣ����Կ����ű���NaHSO3��Һ�ķ������װ��A�����������������Դ��ǣ�����NaHSO3��������Cu��OH��2��ʼ������pHԼΪ5��Ӧѡ���ɫ��Χ�ӽ���ָʾ�����Լ�С�ζ�����ѡ�������ָʾ�������÷�̪��ָʾ��ʱ��Һ�е�Cu 2+���NaOH��Ӧ��Cu��OH��2����ɫ����ŵζ��յ����ȷ�жϣ�����������ʵ���Ϊn������NaOH�����ʵ���Ϊ��amol/L��b��10��3L=ab��10��3mol��H2SO4+2NaOH=Na2SO4+2H2O
����2���ٲⶨSO2��������ȷ�ⶨ��������ģ�����ˮ���ⶨװ��A��������������ʵ�鷽����Dװ���е��Լ�Ӧ���㲻��Ӧ���������ܽ�ȶȽ�С�����������ڱ���NaHSO3��Һ�е��ܽ�Ƚ��ͣ����Կ����ű���NaHSO3��Һ�ķ������װ��A�����������������Դ��ǣ�����NaHSO3��������Cu��OH��2��ʼ������pHԼΪ5��Ӧѡ���ɫ��Χ�ӽ���ָʾ�����Լ�С�ζ�����ѡ�������ָʾ�������÷�̪��ָʾ��ʱ��Һ�е�Cu 2+���NaOH��Ӧ��Cu��OH��2����ɫ����ŵζ��յ����ȷ�жϣ�����������ʵ���Ϊn������NaOH�����ʵ���Ϊ��amol/L��b��10��3L=ab��10��3mol��H2SO4+2NaOH=Na2SO4+2H2O


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ��������������ʵ�ת����ϵ��ͼ��ʾ�����мס���Ϊ���ʣ�������Ϊ����� 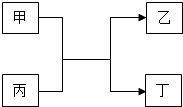
������ҵ���ø÷�Ӧ�ƴֹ�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�����÷�Ӧ�����ں��������ұ�Ϊ����ɫ������÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
������Ϊ���д��Եĺ�ɫ����д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
������Ϊ����ɫ���壬�Ҹ÷�Ӧ�������鹤ҵ�ϼ��Ƿ�й©��д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʽΪC3H6Cl2���л��������һ����ԭ�ӱ���ԭ��ȡ��������������ֿ��ܵĽṹ��ԭ�л���Ľṹ��ʽΪ��������
A.CH2Cl��CH2��CH2Cl
B.CHCl2��CH2��CH3
C.CH2Cl��CHCl��CH3
D.CH3��CCl2��CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йظ�����ϵ��˵����ȷ����
A. ����������һ���ǽ���������
B. �������ڻ�ѧ��Ӧ��һ��������
C. ����������һ���Ƿǽ���������
D. Ħ��������ͬ��������Ħ�����һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��F�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ������������A�Ļ�̬ԭ��2p�ܼ�����2����������C�ǵؿ��к�������Ԫ����E�ĵ��ʳ��³�ѹ��Ϊ����ɫ���壬��ѧ����ʮ�ֻ��ã����ж�����Fλ��ds���������ܲ��е����ӣ����Ⱥ͵���ѵ���֮һ��D��F��ͬ���ڣ��������ܲ��������ȡ�
��1��д����̬Cԭ�ӵĵ����Ų�ʽ: ____________��
��2��A��B��C����Ԫ�ص�һ������������____________��(��Ԫ�ط��ű�ʾ)����ԭ����____________��
��3��B��C��Ԫ���γɵĻ�����B2C�ķ��ӿռ乹��Ϊ____________����B2C��Ϊ�ȵ���������ӵĻ�ѧʽΪ____________��(��һ��)��
��4��D��E�γɵ�һ�����ӻ�����ھ����ṹͼ�к����ʾE��λ�ã������ʾD��λ�ã���֪�þ����ı߳�Ϊncm,�����ӵ�����ΪNA�������ܶ���=_______g/cm3(�ú�n��NA�ļ���ʽ��ʾ)��
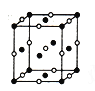
��5����Fԭ���γɵľ����ṹ��ͼ��Fԭ�ӵİ뾶Ϊr����ʽ��ʾFԭ���ھ����еĿռ�������:__________________(��Ҫ�������)��
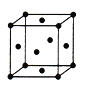
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼX��Y�ֱ���ֱ����Դ��������ͨ�����a�����������ӣ�d��������ɫ��������ų���������һ������ǣ� ��
ѡ�� | a ���� | d���� | X���� | ������Һ |
A | п | ͭ | ���� | CuSO4 |
B | ʯī | ʯī | ���� | NaOH |
C | �� | �� | ���� | AgNO3 |
D | ͭ | ʯī | ���� | CuCl2 |
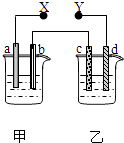
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ�����˵���������
A.̼�����ƿ����ڱ��Ƹ��
B.ľ����ά��������������ˮ������ɫ
C.Ư�ۿ�������Ӿ����ˮ������
D.����ϩ���Ͽ����������װ���ϡ�ũ�ñ�Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶����ں����ܱ������У����з�Ӧ��A(s)+2B(g)![]() 2C(g) ��H��0������˵����ȷ����
2C(g) ��H��0������˵����ȷ����
A. �ﵽƽ������������߲��ַ�Ӧ��A��������Ӧ���ʽ��½�
B. �����������ܶȲ��ٷ����仯ʱ��˵����Ӧ�ﵽƽ��״̬
C. �ı䷴ӦǰA��B��Ͷ�ϱȣ���H��������Ӧ�ĸı�
D. ��Ӧ��ϵ�м���ͨ������B���壬A�п��ܷ�Ӧ��ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�A��B��C��D��E��X�����ڱ�����Ԫ����ɵij������ʻ�� 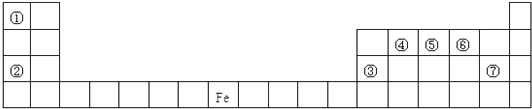
��֪A��B��C��D��E��X������ͼ��ʾת����ϵ������������ͷ�Ӧ������ȥ��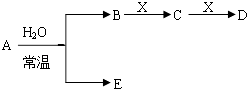
��1����EΪ�������A��ˮ��Ӧ�Ļ�ѧ����ʽΪ �� �ٵ�X�Ǽ�������Һ��C��������22������ʱ����ʾX�ʼ��Ե����ӷ���ʽΪ �ڵ�XΪ��������ʱ����X��B��ϡ��Һ��Ӧ����C�����ӷ�Ӧ����ʽΪ
��2����EΪ�������壬DΪ��ɫ������A�Ļ�ѧʽ������ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com