
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、NaAlO2溶液中加入过量盐酸:AlO2-+H++H2O=Al(OH)3↓ |
| C、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O |


科目:高中化学 来源: 题型:
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
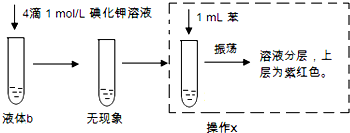 据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:
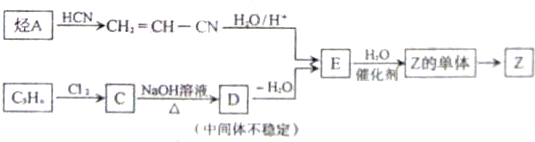

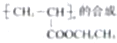 实验,此实验过程涉及的反应类型有
实验,此实验过程涉及的反应类型有查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | T/K | 大理石 规格 | C(HNO3)/ mol?L-1 | 实验目的 |
| ① | 25℃ | 粗颗粒 | 2.00 | (Ⅰ) 实验①和②探究HNO3浓度对该反应速率的影响;则T1为: (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | T1 | 粗颗粒 | 1.00 | |
| ③ | 35℃ | 粗颗粒 | 2.00 | |
| ④ | 25℃ | 细颗粒 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
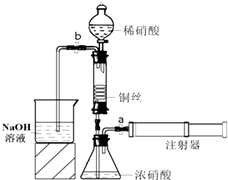 某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:
某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管
| ||
| 2 | 50 | 不足试管
| ||
| 3 | 0 | 液面上升超过实验1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol?L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
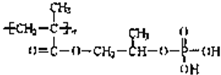

| 新制Cu(OH)2+NaOH/△ |
| ① |
| H2O/△ |
| ② |
| +D |
| ⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com