
| A. | CH3CH2Br$→_{水}^{NaOH}$ CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br | |
| B. | CH3CH2Br $\stackrel{HBr}{→}$ CH2BrCH2Br | |
| C. | CH3CH2Br $→_{水}^{NaOH}$ CH2=CH2 CH2BrCH3$\stackrel{HBr_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br $→_{醇}^{NaOH}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br |
分析 溴乙烷含有溴原子,可在氢氧化钠水溶液中发生水解反应,在氢氧化钠醇溶液中发生消去反应,应先发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,要考虑到反应原理是否正确外,还要考虑到对环境是否造成污染,以及生产成本问题,以此解答该题.
解答 解:A.溴乙烷在氢氧化钠醇溶液加热条件下直接生成烯,原理复杂,故A错误;
B.溴乙烷与HBr不反应,不能制备1,2-二溴乙烷,故B错误;
C.溴乙烷在氢氧化钠水溶液中发生水解反应生成乙醇,不能生成乙烯,故C错误;
D.溴乙烷在氢氧化钠醇溶液、加热条件下发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2二溴乙烷,原理正确,不存在其它副产物,故D正确,
故选D.
点评 本题考查有机物的合成,是高考中的常见题型,属于中等难度的试题.有利于拓展学生的视野,开阔学生的思维,提高学生的学习效率,题目难度中等.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
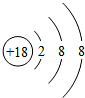 ,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.
,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.80 mol | B. | 0.72 mol | C. | 0.45 mol | D. | 0.40 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油里含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含有C18以上的烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油的分馏是一个物理过程,而裂化及裂解属于化学过程 | |
| D. | 石油裂解的惟一目的是获得乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
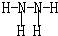 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
;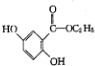 )的一种同分异构体的结构简式
)的一种同分异构体的结构简式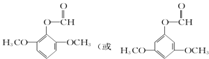 ;
; )的合成路线流程图(无机试剂任用),相关信息:
)的合成路线流程图(无机试剂任用),相关信息: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com