
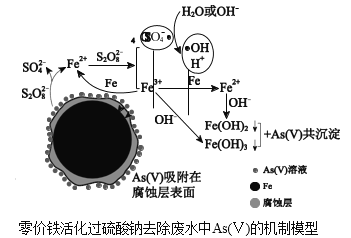
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如图。
资料:
Ⅰ.酸性条件下SO![]() 为主要的自由基,中性及弱碱性条件下SO
为主要的自由基,中性及弱碱性条件下SO![]() ·和·OH同时存在,强碱性条件下·OH为主要的自由基。
·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是_____。
②砷酸的化学式是_____,其酸性比H3PO4_____(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O![]() 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①零价铁与过硫酸钠反应的离子方程式是_____。
②Fe3+转化为Fe2+的离子方程式是_____。
③SO![]() ·和H2O反应的离子方程式是_____。
·和H2O反应的离子方程式是_____。
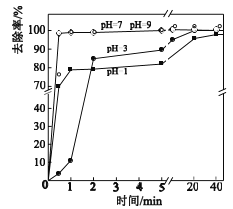
(3)不同pH对As(Ⅴ)去除率的影响如图。5min内pH=7和pH=9时去除率高的原因是_____。
【答案】第4周期、第ⅤA族 H3AsO4 弱 Fe+S2O![]() =Fe2++2SO
=Fe2++2SO![]() Fe+2Fe3+=3Fe2+ SO
Fe+2Fe3+=3Fe2+ SO![]() ·+H2O=·OH+SO
·+H2O=·OH+SO![]() +H+ pH=7和pH=9时,产生了具有强氧化性的SO
+H+ pH=7和pH=9时,产生了具有强氧化性的SO![]() ·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)
·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)
【解析】
(1)①磷元素的原子序数为15,位于元素周期表第3周期ⅤA族,由砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层;
②砷与磷在元素周期表中位于同一主族,同主族元素性质相似,同主族元素,从上到下非金属性依次减弱,最高价氧化物对应水化物的酸性减弱;
(2)①由题意可知,零价铁与过硫酸钠反应生成Fe2+和SO42-;
②Fe3+具有氧化性,Fe与Fe3+发生氧化还原反应生成Fe2+;
③由题给信息可知,SO4—·和H2O反应生成·OH+SO42—;
(3)结合零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型可知,因pH = 7和pH = 9时,产生了具有强氧化性的SO4·和·OH,利于生成Fe2+和Fe3+,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀。
(1)①磷元素的原子序数为15,位于元素周期表第3周期ⅤA族,由砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层可知砷位于元素周期表中第4周期ⅤA族,故答案为:第4周期ⅤA族;
②砷与磷在元素周期表中位于同一主族,同主族元素性质相似,则由磷酸分子式可知,砷酸中砷元素的化合价为+5价,化学式是H3AsO4;同主族元素,从上到下非金属性依次减弱,最高价氧化物对应水化物的酸性减弱,则H3AsO4酸性比H3PO4弱,故答案为:H3AsO4;弱;
(2)①由题意可知,零价铁与过硫酸钠反应生成Fe2+和SO42-,反应的离子方程式为Fe+ S2O82=Fe 2+ +2SO42,故答案为:Fe+ S2O82=Fe 2+ +2SO42;
②Fe3+具有氧化性,Fe与Fe3+发生氧化还原反应生成Fe2+,反应的离子方程式为Fe+ 2Fe 3+=3Fe 2+,故答案为:Fe+ 2Fe 3+=3Fe 2+;
③由题给信息可知,SO4—·和H2O反应生成·OH+SO42—,反应的离子方程式是SO![]() ·+H2O=·OH+SO
·+H2O=·OH+SO![]() +H+,故答案为:SO
+H+,故答案为:SO![]() ·+H2O=·OH+SO
·+H2O=·OH+SO![]() +H+;
+H+;
(3)结合零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型可知,因pH = 7和pH = 9时,产生了具有强氧化性的SO4·和·OH,利于生成Fe2+和Fe3+,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ),则5 min内pH = 7和pH = 9![]() ·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)。
·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是( )
A.C2H5Cl、CH3CH2ClB.OH﹣、![]()
C.![]() 、
、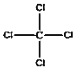 D.C2H6O、CH3CH2OH
D.C2H6O、CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO![]() 、NO
、NO![]() 等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A. Na+、Ba2+、Cl-、SO42— B. MnO4-、K+、I-、H+
C. Ca2+、HCO3—、Cl-、K+ D. H+、Cl-、Na+、CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铁 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是___。
(3)属于非电解质的是____。
(4)⑥和水蒸气反应的化学方程式为___,①与②在溶液中反应使溶液呈中性的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车目前一般使用镍氢电池(M表示储氢合金;汽车在刹车或下坡时,电池处于充电状态)。镍氢电池充放电原理的示意图如下:

其总反应式为![]() 。根据所给信息判断,下列说法错误的是
。根据所给信息判断,下列说法错误的是
A. 混合动力汽车上坡或加速时,乙电极的电极反应式为:NiOOH+H2O+eˉ==Ni(OH)2+OHˉ
B. 混合动力汽车上坡或加速时,电解液中OHˉ向甲电极移动
C. 混合动力汽车下坡或刹车时,甲电极周围溶液的pH减小
D. 混合动力汽车下坡或刹车时,电流的方向为:甲电极→发动机→乙电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-测定的基本原理是将其氧化成I2,再用Na2S2O3标准溶液来滴定。如果样品中仅含有微量I-,必须用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是化学放大反应的实验步骤:
I.将含有微量I-的样品溶液调至中性或弱酸性,加入溴水,将I-完全氧化成IO![]() ,煮沸去掉过量的溴;
,煮沸去掉过量的溴;
Ⅱ.取上述溶液,加入过量硫酸酸化的KI溶液,振荡,溶液颜色呈棕黄色;
Ⅲ.将Ⅱ所得溶液中全部的I2萃取至CCl4中;
Ⅳ.向分液后的CCl4溶液中加入肼(N2H4)的水溶液,产生无毒的N2,分去有机层;
V.将Ⅳ所得水溶液重复I、Ⅱ步骤;
Ⅵ.以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。已知:反应为:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() ;Na2S2O3和Na2S4O6溶液颜色均为无色。
;Na2S2O3和Na2S4O6溶液颜色均为无色。
(1)I中氧化剂和还原剂物质的量之比为______。
(2)Ⅲ中使用的主要玻璃仪器是______(填名称)。
(3)Ⅳ中反应的离子方程式是______。
(4)Ⅵ中需要在中性或弱酸性环境中进行,pH过大,Na2S2O3易被I2氧化成Na2SO4,其离子方程式为_______;结合离子方程式解释pH不宜过小的原因:______。VI中滴定终点的现象是______。
(5)样品中I-最终所消耗的Na2S2O3的物质的量与样品中初始I-物质的量的比值称为“放大倍数”。经过以上操作,放大倍数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA (g) + bB (s) ![]() cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
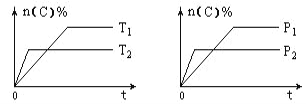
A. 温度降低,化学平衡向逆反应方向移动
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a <c+d
D. 无法根据图像确定改变温度后化学平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL0.12 mol/L AgNO3溶液中逐滴加入浓度为2%的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加入氨水的体积V与溶液中lg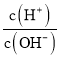 的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是( )
的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是( )
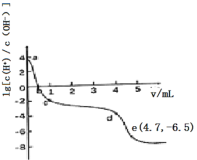
A.a点溶液呈酸性的原因是AgNO3水解
B.b点溶液中:c(Ag+)+c[Ag(NH3)2+]<c(NO3-)
C.由e点可知,反应Ag++2NH3![]() [Ag(NH3)2]+平衡常数的数量级为105
[Ag(NH3)2]+平衡常数的数量级为105
D.c~d段加入的氨水主要用于沉淀的生成和溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com