
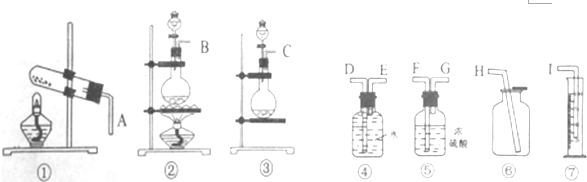
分析 (1)含Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度,根据题中提供的装置可知,该实验利用氧化钠和过氧化钠与水反应,其中过氧化钠与水反应产生氧气,称取一定量的样品,使其与水反应,根据产生的氧气的体积可计算出过氧化钠的质量,进而确定过氧化钠的质量分数,本实验中测量气体的体积是用排水量气法,据此确定实验装置的连接顺序;
(2)氧化钠和过氧化钠均能和水反应;
(3)由于过氧化钠与水反应是放热反应,为了准确测量气体的体积,要使气体的温度与室温相同,同时也要使集气瓶中的压强与大气压相同;
(4)根据过氧化钠与水反应生成氧气,可以用排水量气法测定氧气的体积,根据氧气的体积可计算出过氧化钠的质量,结合样品的质量可确定过氧化钠的百分含量.
解答 解:(1)含Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度,根据题中提供的装置可知,该实验利用氧化钠和过氧化钠与水反应,该反应不需要不加热,其中过氧化钠与水反应产生氧气,称取一定量的样品,使其与水反应,根据产生的氧气的体积可计算出过氧化钠的质量,进而确定过氧化钠的质量分数,本实验中测量气体的体积是用排水量气法,所以实验装置的连接顺序为C接E,D接I,
故答案为:C接E,D接I;
(2)实验中氧化钠和过氧化钠均能和水反应,方程式为:2Na2O2+2H2O=4NaOH+O2↑;Na2O+H2O=2NaOH,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;Na2O+H2O=2NaOH;
(3)由于过氧化钠与水反应是放热反应,为了准确测量气体的体积,要使气体的温度与室温相同,所以测量气体时要冷却到室温,同时也要使集气瓶中的压强与大气压相同,所以在读数时,注意量筒中液面的高度与集气瓶中液面的高度相同,
故答案为:读数时气体要冷却到室温、量筒中液面的高度与集气瓶中液面的高度相同;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为VmL(标准状况),即生成的氧气的物质的量为$\frac{0.001V}{22.4}$mol,过氧化钠的物质的量为$\frac{0.001V}{22.4}$×2mol,
过氧化钠的纯度=$\frac{\frac{0.001V}{22.4}×78×2}{a}$×100%=$\frac{39V}{56a}$%,
故答案为:$\frac{39V}{56a}$%.
点评 本题主要考查学生金属钠的氧化物和过氧化物的性质以及用排水量气法测定气体的体积的方法,难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数小于2NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
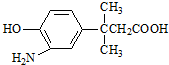 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱上共有7个峰 | |
| C. | 该物质遇FeCl3溶液显色 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol N2,电子转移总数为3NA | B. | 生成1 mol N2,电子转移总数为5NA | ||
| C. | 溶解1 mol Zn,电子转移总数为2NA | D. | 溶解1 mol Zn,电子转移总数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com