
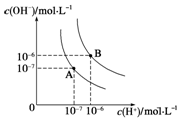
 水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1.
水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1. 分析 Kw=c(H+)•c(OH-),升高温度,水的电离程度增大,水的离子积Kw增大,升温促进水的电离,氢离子浓度增大,据此判断A、B;氢氧化钠抑制了水的电离,溶液中的氢离子是水电离的,据此计算出水电离的氢离子浓度;100℃时pH=7溶液呈碱性,设出两溶液体积,然后列式计算.
解答 解:A点c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)•c(OH-)=10-14 ,故A点为25℃;B点c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)•c(OH-)=10-12 ,故B点为100℃;
100℃时1mol•L-1 的NaOH溶液中Kw=c(H+)•c(OH-)=10-12 ,c(OH-)=1mol/L,氢氧化钠抑制了水的电离,溶液中的氢离子是水的电离的,则水电离出的c(H+)=1×10-12;
100℃时Kw=c(H+)•c(OH-)=10-12 ,5×10-5 mol•L-1的H2SO4溶液中氢离子浓度为1×10-4 mol•L-1,pH=9的Ba(OH)2溶液中氢氧根离子浓度为:$\frac{1×1{0}^{-12}}{1{0}^{-9}}$mol/L=1×10-3mol•L-1,混合后pH=7,溶液呈碱性,反应后溶液中氢氧根离子浓度为:$\frac{1×1{0}^{-12}}{1{0}^{-7}}$mol/L=1×10-5mol•L-1,
设混合前H2SO4溶液与Ba(OH)2溶液的体积分别为x、y,则$\frac{1×1{0}^{-3}×y-1×1{0}^{-4}×x}{x+y}$=1×10-5,解得x:y=9:1,
故答案为:A,1×10-12; 9:1 (或9).
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确水的电离及其影响为解答关键,注意熟练掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2的摩尔质量是71g | |
| B. | 1molCl2中所含分子数约为6.02×1023 | |
| C. | 1molCl2的质量是71g•mol-1 | |
| D. | 常温常压下,1molCl2的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗从食醋中分离出乙酸 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH溶液除去Cl2中含有的少量HCl | |
| D. | 用KSCN溶液检验FeCl3溶液 中是否含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:NH4+、Fe3+、CO32-、SO42- | |
| B. | 含有大量AlO2-的溶液中:Fe2+、Cu2+、Cl-、Na+ | |
| C. | 中性溶液中:Fe3+、Al3+、Na+、K+、NO3- | |
| D. | Na2S溶液中:K+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
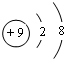 ,C的原子结构示意图为
,C的原子结构示意图为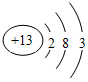 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
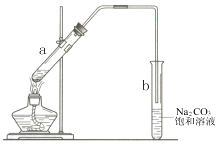
| A. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com