
分析 (1)溶液中氢氧根离子浓度越大,溶液的pH越大,据此进行解答;根据乙溶液中氢氧根离子浓度计算其pH;
(2)盐酸中氢离子抑制了水的电离,则盐酸中的氢氧根离子是水的电离的;醋酸钠中的氢氧根离子是水的电离的,据此计算出常溫下pH=9的醋酸钠溶液中水电离出的c(0H-);
(3)醋酸与氢氧化钠溶液恰好反应生成醋酸钠,由于醋酸根离子部分水解,则醋酸钠溶液呈碱性;
(4)溶解度越大,溶度积越大;向AgCl与 AgBr的饱和溶液中,加入AgNO3,AgCl与AgBr的溶解平衡向左移动,但AgBr的溶解度更小,溶液中AgCl沉淀较多.
解答 解:(1)甲:0.1mol/L氨水中氢氧根离子浓度小于0.1mo/L,乙:0.1mol/L氢氧化钾溶液丙中氢氧根离子浓度为0.1mol/L;丙:0.1mol/L氢氧化钡溶液中氢氧根离子浓度为0.2mol/L,氢氧根离子浓度越大,溶液的pH越大,则三种溶液的pH小到大的排列顺序为:甲<乙<丙;
乙溶液中氢氧根离子浓度为0.1mol/L,该溶液的pH=13,
故答案为:甲<乙<丙;13;
(2)盐酸中氢离子抑制了水的电离,则盐酸中氢氧根离子是水的电离的,所以常温下pH=2的盐酸中水电离出c(H+)=10-12mol/L;
常溫下pH=9的醋酸钠溶液中,醋酸根离子水解促进了水的电离,则醋酸钠溶液中水电离出的c(0H-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,
故答案为:10-12;10-5;
(3)等体积、等物质的量的浓度的氢氧化钠溶液与醋酸溶液混合,二者恰好反应生成醋酸钠,反应的化学方程式为:NaOH+CH3COOH=CH3COONa+H2O;醋酸钠溶液中,由于醋酸根离子部分水解,溶液呈碱性,则醋酸钠溶液呈碱性,反应的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:NaOH+CH3COOH=CH3COONa+H2O;CH3COO-+H2O?CH3COOH+OH-;
(4)溶解度越大,则难溶物的溶度积越答,则20℃时AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g,则Ksp(AgCl)>Ksp (AgBr);
在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多,所以d正确,
故答案为:>;d.
点评 本题考查较为综合,涉及酸碱混合的定性判断、水的电离及其影响、溶液pH的计算等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
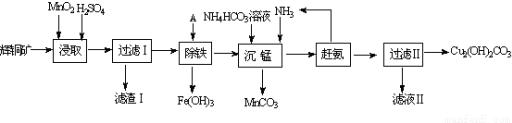
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与足量的Cl2反应转移的电子数为2NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | 常温、常压下,22gCO2中含有的氧原子数为NA | |
| D. | 0.11mol/LCaCl2溶液中含氧离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,c(HCO3-)减小 | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变小 | |
| C. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
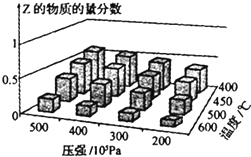 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )| A. | △H>0 | |
| B. | 升温,正、逆反应速率都增大,平衡常数减小 | |
| C. | 增大压强,Z的含量减小 | |
| D. | 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、过滤、蒸发、洗涤 | B. | 溶解、蒸发、洗涤、过滤 | ||
| C. | 溶解、过滤、洗涤、干燥 | D. | 溶解、洗涤、过滤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中,这些离子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的过程中,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终不变 | |
| C. | 苯酚钠溶液中通入少量CO2,发生反应:2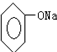 +H2O+CO2→2 +H2O+CO2→2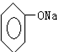 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亚铁溶液中滴入盐酸的离子反应方程式为:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com