
【题目】某铁红涂料中添加有CuO或FeO中的一种,为探究添加物的成分设计如下实验方案。
(1)请写出实验步骤、预期现象,对应的离子方程式。
(限选试剂:铁粉、3mol/LH2SO4、0.1mol/L酸性KMnO4溶液、10%H2O2、KSCN溶液)

①_____________,②_____________,_____________,③___________,_____________
④操作步骤③中反应的离子方程式为____________。
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验。
已知:气体由草酸晶体受热分解得到:H2C2O4·2H2O ![]() CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。
CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。
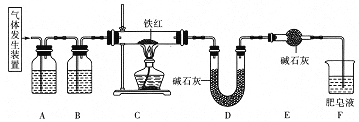
①装置A、B中的试剂依次是_____、______。
②气体通入后,接下来的操作是____,然后对C装置加热。
③实验前后称得D装置增重8.8g,则此铁红中铁的质量分数是___________。
【答案】 Fe+Cu2+===Fe2++Cu 0.2 2Fe2++Cl2===2Fe3++2Cl- 2Fe3++3Cl2+8H2O===2FeO![]() +6Cl-+16H+ O2+2H2O+4e-===4OH- 阴 2Cl--2e-===Cl2↑ 属铬的活动性比铜的强且能和稀硫酸反应生成H2 金 金属铬易被稀硝酸钝化
+6Cl-+16H+ O2+2H2O+4e-===4OH- 阴 2Cl--2e-===Cl2↑ 属铬的活动性比铜的强且能和稀硫酸反应生成H2 金 金属铬易被稀硝酸钝化
【解析】(1)氧化铜可以溶解于强酸溶液中,得到含有铜离子的盐,加入足量铁粉可以将金属铜置换出来,据此可以检验固体是氧化铜,氧化亚铁可以和强酸反应生成亚铁盐,能使高锰酸钾褪色,据此可以检验固体中含有氧化亚铁,
实验方案设计为:
实验操作 | 预期现象和结论 |
①加入足量的3molL-1H2SO4,充分振荡. | 样品全部溶解 |
②取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3molL-1H2SO4,充分振荡. | 试管中出现红色固体,说明试样中有CuO |
③取少许溶液于试管中,逐滴加入0.01molL-1酸性KMnO4溶液 | 如果紫红色褪去,发生的离子反应方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O说明试样中有FeO; |
故答案为:①3mol/LH2SO4;②向一支试管中加入足量铁粉,充分振荡;再加入足量3mol/LH2SO4,充分振荡; 出现红色固体;③向另一支试管中加入0.01mol/L酸性KMnO4溶液;紫红色褪去;④5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(2)①草酸分解生成的气体中含有二氧化碳和一氧化碳,C中发生一氧化碳与铁红的反应生成二氧化碳,D是吸收二氧化碳的装置,通过D装置的质量变化来测定的,因此需要除去加入C中气体中的二氧化碳,并干燥,装置A、B中的试剂依次是氢氧化钠溶液和浓硫酸,故答案为:氢氧化钠溶液;浓硫酸;
②一氧化碳具有可燃性,需要验纯,操作为用点燃的小木条靠近肥皂泡,直到肥皂泡安静燃烧,一氧化碳纯净后才能对C装置加热,故答案为:用点燃的小木条靠近肥皂泡,直到肥皂泡安静燃烧;
③实验前后称得D装置增重8.8g,表示生成的二氧化碳为8.8g,物质的量为![]() =0.2mol,说明样品中含有0.2molO元素,质量为0.2mol×16g/mol=3.2g,则此铁红中铁的质量分数是
=0.2mol,说明样品中含有0.2molO元素,质量为0.2mol×16g/mol=3.2g,则此铁红中铁的质量分数是![]() ×100%=72.41%,故答案为:72.41%。
×100%=72.41%,故答案为:72.41%。


科目:高中化学 来源: 题型:
【题目】元素周期表中16号元素和4号元素原子的下列数据相比较,前者一定是后者4倍的是( )
A. 中子数 B. 最外层电子数
C. 电子层数 D. 次外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有五种操作方法,在油脂皂化后,使肥皂和甘油从混合物中充分分离,可以采用的方法是( )
①分液 ②蒸馏 ③过滤 ④盐析 ⑤渗析
A.①②
B.③④
C.②③④
D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2 . 现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高 度分别为h1、h2、h3、h4 , 则高度关系是( )
A.h4>h2>h3>h1
B.h4>h3>h2>h1
C.h2>h3>h1>h4
D.h3>h2>h1>h4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是
A. b<0.01
B. 混合后溶液呈中性
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总蓄水量的97.2%,若把海水的淡化和化工生产结合起来,就可充分利用海洋资源来解决淡水资源缺乏的问题。
(1)氯化钠中的金属元素在周期表中的位置是_________;
(2)目前常用的“海水淡化”主要技术之一是蒸馏法,蒸馏法属于________(填“物理变化”或“化学变化”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. MgCl2=Mg2++Cl-
B. Ba(OH)2=Ba++2OH-
C. HNO3=H++NO3-
D. NH4Cl=N3-+4H++Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在氧气中完全燃烧的化学方程式为:Si+O2 ![]() SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
A.1mol
B.2mol
C.3mol
D.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com