
 ,
, ;
;| Cu |
| Cu |


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
| A、页岩气是从页岩层中开采出来的天然气.产气页岩分布广、厚度大,且普遍含气,故可以成为提供廉价而充足的新型燃料来源 |
| B、2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| C、目前我市的汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 |
| D、竹炭具有超强的吸附能力,能吸附新装修房屋内的所有有害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁 |
| B、炼钢主要目的是在高温下用还原剂将过多的碳和其他杂质还原成气体或炉渣除去 |
| C、炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材 |
| D、电解铝时阴极材料需要定期更换. |
查看答案和解析>>
科目:高中化学 来源: 题型:
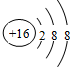
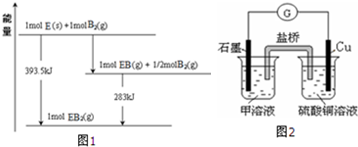
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
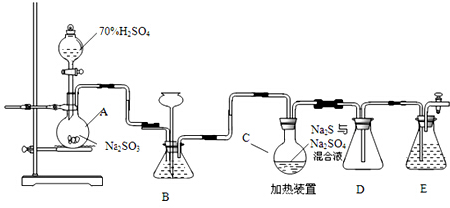
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
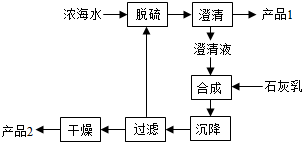
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
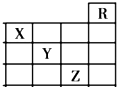 如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )| A、只有③ | B、只有①④ |
| C、只有①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有化学键断裂的过程一定发生化学变化 | ||
| B、氯化钠是一种电解质,电解饱和食盐水可制得金属钠 | ||
C、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| D、SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com