
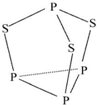
 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )| A. | 该物质中磷元素的化合价为+3 | |
| B. | 该物质分子中不含非极性共价键 | |
| C. | 该物质的熔、沸点比P4低 | |
| D. | 该物质22 g含硫原子的数目约为1.806×1023 |
分析 A、根据化合物中化合价的代数和为零计算;
B、根据共价键类型判断;
C、分子晶体的熔点高低比较相对分子量的大小;
D、根据质量求出分子数,再求出原子数.
解答 解:A、由图可知,有1个P结合3个S为+3价,其它3个P结合1个S都是+1价,正价总数为+6,而S为-2价,故A错误;
B、该分子中全部为单键,含有P-P非极性键,故B错误;
C、三硫化四磷属于分子晶体,相对分子量大于P4,则分子晶体的熔点较高,所以该物质的熔、沸点比P4高,故C错误;
D、该物质22g含硫原子的物质的量为$\frac{22g}{220g/mol}$×3=0.3mol,则其原子数为1.806×1023,故D正确;
故选D.
点评 本题属于信息习题,学生应利用物质的结构来分析成键、元素的化合价等,并学会结合所学知识及巧妙利用信息来解答问题,题目难度不大.


科目:高中化学 来源: 题型:解答题
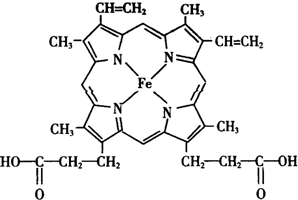 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: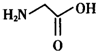 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.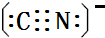 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
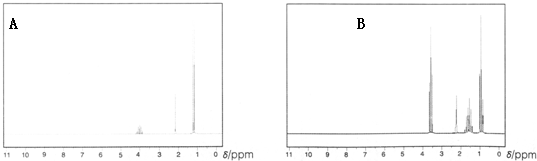
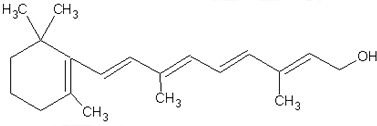
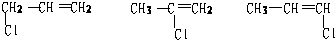 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学利用下列实验装置图探究铜与稀硝酸反应的还原产物并进行喷泉实验(假设药品足量),请回答下列问题:
某同学利用下列实验装置图探究铜与稀硝酸反应的还原产物并进行喷泉实验(假设药品足量),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
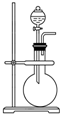 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y | |
| B. | 第一电离能:X>Y | |
| C. | 气态氢化物的稳定性:HmY小于HnY | |
| D. | X与Y形成化合物时,一般显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | 若AB2分子的构型为V型,则A可能为sp2杂化 | |
| D. | H2S和SO2分子中的中心原子杂化类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
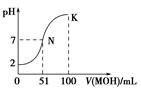 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )| A. | HA为一元强酸 | |
| B. | MOH为一元弱碱 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com