
分析 (1)依据热化学方程式和盖斯定律计算得到对应反应的焓变;
(2)由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,应为原电池的正极,电极反应式为Ag2O+2e-+H2O=Ag+2OH-,电解NaCl溶液时,阳极氯离子失电子生成氯气,根据电子守恒计算.
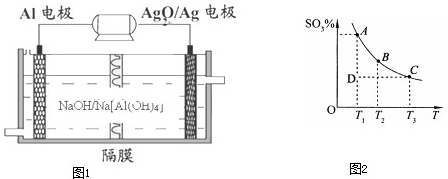
(3)a、恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动;
b、增大生成物的浓度,平衡逆向移动;
c、由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,据此判断;
d、在A点为平衡点,正逆反应速率相等进行判断.
e、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行建立平衡.
解答 解:(1)①2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g);△H=a kJ•mol-1
②3AlCl(g)=2Al(l)+AlCl3(g);△H=b kJ•mol-1
依据盖斯定律①×3+②×6得到:6Al2O3(s)+18C(s)=12Al(l)+18CO(g)△H=(3a+6b)KJ/mol,即Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(0.5a+b)KJ/mol,
故答案为:0.5a+b;
(2)由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,应为原电池的正极,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,电解NaCl溶液时,阳极氯离子失电子生成氯气,则阳极的电极反应式为2Cl--2e-=Cl2↑;电解反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2OH-;消耗27mg Al,则铝的物质的量为$\frac{m}{M}$=$\frac{27×1{0}^{-3}g}{27g/mol}$=0.001mol,则转移电子为0.003mol,
由电解方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2OH-可知,转移2mol电子生成2molOH-,则转移0.003mol电子时,溶液中生成0.003molOH-,
所以c(OH-)=$\frac{0.003mol}{0.3L}$=0.01mol/L,则溶液的pH=12;
故答案为:Ag2O+2e-+H2O=2Ag+2OH-;2Cl--2e-=Cl2↑;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2OH-;12;
(3)a、恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动,故错误;
b、增大生成物的浓度,平衡逆向移动,若在恒温、恒容条件下向上述平衡体系中通入SO3(g),生成物的浓度增大,平衡向左移动,故b错误;
c、由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,K值减小,故平衡常数K1>K2,故错误;
d、在A点为平衡点,正逆反应速率相等,所以消耗1mol SO2必定同时消耗1mol SO3,故正确;
e、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行建立平衡,所以V正>V逆,故正确;
故选:de.
点评 本题考查了盖斯定律的应用、电解原理的应用和电子守恒在计算中的应用、化学平衡移动、平衡常数的影响因素等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
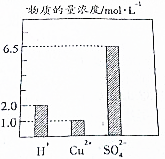 在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:6:1 | B. | 8:6:1 | C. | 3:3:1 | D. | 2:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
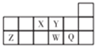
| A. | 离子Y2-和Z3+的核外电子排布相同 | |
| B. | X3-的离子半径小于Z3+的离子半径 | |
| C. | 元素Y的最高正价与最低负价绝对值之和为8 | |
| D. | 元素W的气态氢化物的稳定性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定是ⅡA元素 | |
| B. | 第三周期元素对应的离子半径从左往右依次减小 | |
| C. | 第ⅦA族元素从上到下,其氢化物的酸性逐渐减弱 | |
| D. | 第三周期的主族元素的最高正价一定等于其最外层电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com