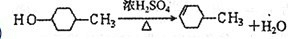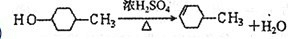(2011?江西一模)【实验探究】已知稀溴水和氯化铁溶液都呈黄色.现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究.?
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉-碘化钾溶液.?
完成以下实验探究过程:
【提出假设】假设1:溶液呈黄色不是发生化学反应所致,是溶液中
Br2
Br2
引起的(填微粒的化学式,下同).
假设2:溶液呈黄色是发生化学反应所致,是溶液中
Fe3+
Fe3+
引起的.?
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:?验证假设1的方案:
向黄色溶液中加入CCl4,振荡,静置,下层溶液呈橙红色
向黄色溶液中加入CCl4,振荡,静置,下层溶液呈橙红色
,本方案所用到的主要玻璃仪器有:
分液漏斗,烧杯
分液漏斗,烧杯
.?验证假设2的方案:
向黄色溶液中滴加KSCN溶液,溶液变为血红色
向黄色溶液中滴加KSCN溶液,溶液变为血红色
.?
(2)根据高中所学的知识判断,你认为
假设2
假设2
(填“假设1”或“假设2”)的推断是正确的;若选用淀粉-碘化钾溶液验证你的假设是否可行?
不可行
不可行
(填“可行”或“不可行”),理由是
因为Br2和Fe3+都能把I-氧化成I2,使溶液变蓝,无法得出结论
因为Br2和Fe3+都能把I-氧化成I2,使溶液变蓝,无法得出结论
.
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为
2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
.



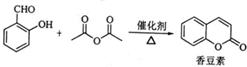
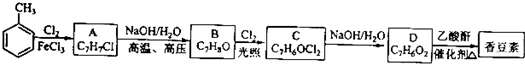








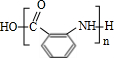



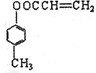
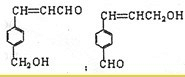
 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 最合理的方案(不超过4步).
最合理的方案(不超过4步).