
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、氧化剂得电子数与还原剂失电子数之比为1:1 |
| C、NaCl是氧化产物 |
| D、被氧化的氯原子和被还原的氯原子的物质的量之比为1:1 |
| ||


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、等于0.6mol |
| B、等于1mol |
| C、大于0.6mol小于1mol |
| D、大于1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
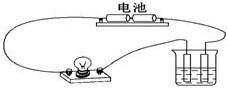 用图示所示装置分别进行如下实验,测定导电性变化,按照要求选择填空.
用图示所示装置分别进行如下实验,测定导电性变化,按照要求选择填空.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、析出2ag硫 | ||
B、析出
| ||
| C、剩余0.5amol气体 | ||
D、剩余
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B、E一定在不同周期 |
| B、A、D可能在同一主族 |
| C、C元素的最高价氧化物对应的水化物可能显碱性 |
| D、C和D单质化合可能形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com