
【题目】有下列几组物质,请将序号填入下列空格内:
A C60和石墨 B 126C和136C C 冰醋酸和乙酸 D CH3CHO与![]() E 甲烷和十二烷 F 乙醇和乙二醇
E 甲烷和十二烷 F 乙醇和乙二醇
①互为同位素的是_________;
②互为同系物的是___________;
③互为同分异构体的是________;
科目:高中化学 来源: 题型:
【题目】20 ℃时向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH溶液,溶液pH变化如图所示。此过程中溶液中离子浓度的关系错误的是( )
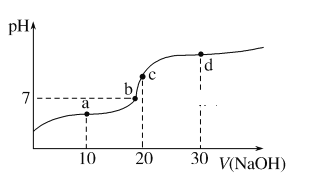
A. a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C. c点:c(H+)=c(CH3COO-)+c(OH-)
D. d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______。
(2)还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_______。
Ⅱ.利用Cu2O光催化处理含Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出Cr2O72-转化Cr3+的电极反应:_______。
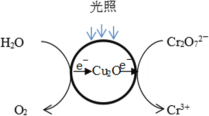
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是2×10-4mol/L,Cr2O72-的初始浓度是1×10-3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______,依据是_______。

(3)溶液的pH对Cr2O72-降解率的影响如图所示。
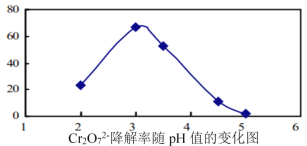
已知:Cu2O![]() Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
①pH分别为2、3、4时,Cr2O72-的降解率最好的是___________,其原因是___________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物的热稳定性:W>R
C.WX3和水反应生成的化合物是离子化合物
D.X元素在自然界中存在同素异形现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
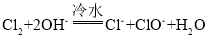 、
、![]()
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:
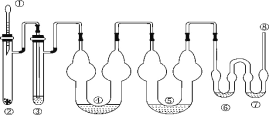
装置中盛装的药品如下:
①胶头滴管中装有 5 mL 浓盐酸;②微型具支试管中装有 1.5 g KMnO4;③微型具支试管中装有 2~3 mL 浓硫酸;④U 形反应管中装有 30% KOH 溶液;⑤U 形反应管中装有 2 mol·L-1 NaOH 溶液;⑥、⑦双 U 形反应管中分别装有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾气出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是_________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为_______、_______。
(3)装置⑥⑦中能够观察到的实验现象分别是_________, _______。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性 Cl2>I2,理由是________。
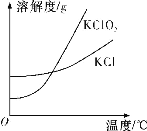
(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是________。
(6)尾气处理时 Cl2 发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有____________(任答两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:______。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是______。
(4)在装置C中应加入____ (填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___ (填“上”或“下”)层。
(6)若产物中有少量副产物乙醚,可用____的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,回答问题。
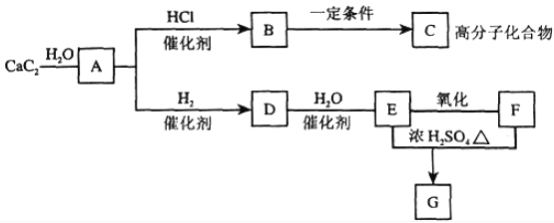
(1)有机物C的结构简式:________。
(2)①反应DE的化学方程式是_____________。
②E和F反应生成G的化学方程式是__________,反应类型为_________。
③实验室制取A的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示
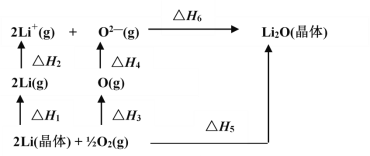
下列说法正确的是
A. △H1< 0,△H2>0B. -△H5 +△H1 +△H1 +△H3+△H4 +△H6 =0
C. △H3<0,△H4 < 0D. △H1+ △H2+△H3 +△H4 =△H5+△H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
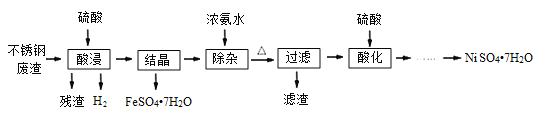 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com