
【题目】三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化、塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:

有关物质的部分性质如下表:

回答下列问题:
(1)仪器a的名称是_____________。装置A中发生反应的化学方程式为_______。
(2)装置C中制备POCl3的化学方程式为________________________________。
(3)C装置控制反应在60~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
II.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀;
III.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
IV.加入指示剂,用c mol·L-1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填序号)________,滴定终点的现象为_____________。
a.酚酞 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量分数为(列出算式)________________。
③若取消步骤III,会使步骤IV中增加一个化学反应,该反应的离子方程式为________;该反应使测定结果________(填“偏大”“偏小”或“不变”)。
【答案】冷凝管 2Na2O2+2H2O=4NaOH+O2↑或2H2O![]() =2H2O+O2↑ 2PCl3+O2=2POCl3 加快反应速率,同时防止PCl3气化,逸出损失 b 当加入最后一滴NH4SCN溶液,溶液刚好变为红色,且红色半分钟内不褪色
=2H2O+O2↑ 2PCl3+O2=2POCl3 加快反应速率,同时防止PCl3气化,逸出损失 b 当加入最后一滴NH4SCN溶液,溶液刚好变为红色,且红色半分钟内不褪色 ![]() AgCl(s)+SCN-(aq)
AgCl(s)+SCN-(aq)![]() AgSCN(s)+Cl-(aq) 偏小
AgSCN(s)+Cl-(aq) 偏小
【解析】
根据实验目的及装置图中反应物的状态,分析装置的名称及装置中的相关反应;根据滴定实验原理及相关数据计算样品中元素的含量,并进行误差分析。
(1)根据装置图知,仪器a的名称是冷凝管;根据实验原理及装置中反应物状态分析知,装置A为用固体和液体制备氧气的装置,可以是过氧化钠与水反应,也可能是双氧水在二氧化锰催化下分解,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑或2H2O![]() =2H2O+O2↑,故答案为:冷凝管;2Na2O2+2H2O=4NaOH+O2↑或2H2O
=2H2O+O2↑,故答案为:冷凝管;2Na2O2+2H2O=4NaOH+O2↑或2H2O![]() =2H2O+O2↑;
=2H2O+O2↑;
(2)装置C中为PCl3与氧气反应生成POCl3的反应,化学方程式为2PCl3+O2=2POCl3,故答案为:2PCl3+O2=2POCl3;
(3)通过加热可以加快反应速率,但温度不易太高,防止PCl3气化,影响产量,则C装置易控制反应在60℃65℃进行,故答案为:加快反应速率,同时防止PCl3气化,逸出损失;
(4)①用cmolL1NH4SCN溶液滴定过量Ag+至终点,当滴定达到终点时NH4SCN过量,加NH4Fe(SO4)2作指示剂,Fe3+与SCN反应溶液会变红色,半分钟内不褪色,即可确定滴定终点;故答案为:b;当加入最后一滴NH4SCN溶液,溶液刚好变为红色,且红色半分钟内不褪色;
②用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL,则过量Ag+的物质的量为Vc×103mol,与Cl反应的Ag+的物质的量为0.1000mol/L×0.04LVc×103mol=(4Vc)×103mol,则Cl元素的质量百分含量为![]() ,故答案为:
,故答案为:![]() ;
;
③已知:Ksp(AgCl)=3.2×1010,Ksp(AgSCN)=2×1012,则AgSCN沉淀的溶解度比AgCl小,可加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;若无此操作,NH4SCN与AgCl反应生成AgSCN沉淀,反应为:AgCl(s)+SCN-(aq)![]() AgSCN(s)+Cl-(aq);则滴定时消耗的NH4SCN标准液的体积偏多,即银离子的物质的量偏大,则与氯离子反应的银离子的物质的量偏小,所以测得的氯离子的物质的量偏小;故答案为:AgCl(s)+SCN-(aq)
AgSCN(s)+Cl-(aq);则滴定时消耗的NH4SCN标准液的体积偏多,即银离子的物质的量偏大,则与氯离子反应的银离子的物质的量偏小,所以测得的氯离子的物质的量偏小;故答案为:AgCl(s)+SCN-(aq)![]() AgSCN(s)+Cl-(aq);偏小。
AgSCN(s)+Cl-(aq);偏小。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】乙酰水杨酸即阿司匹林是最常用的解热镇痛药,其结构如图所示。关于它的描述中不正确的是( )
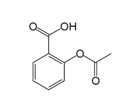
A.分子式为C9H8O4
B.其在酸性条件下水解产物遇氯化铁溶液可以呈现紫色
C.1mol 乙酰水杨酸最多可以与3molH2 反应
D.1mol 乙酰水杨酸最多可以与2molNaOH 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是____________。
,其原因是____________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图1和题图2所示。

①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
(3)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是______。
A.0.1mol/L CH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.含等物质的量的NaX和弱酸HX的混合溶液中一定存在:c(Na+)>c(X-)
C.0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)
(4)下列图示与对应的叙述不相符的是______。

A.图1表示可逆反应“2X(g) ![]() Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20 mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:
①液氯② ③白磷④氯气⑤
③白磷④氯气⑤ ⑥
⑥![]() Cl⑦
Cl⑦![]() Cl⑧红磷⑨氢氧化钠⑩氩
Cl⑧红磷⑨氢氧化钠⑩氩
(1)互为同分异构体的有___;
(2)互为同素异形体的有___;
(3)属于同位素的有___;
(4)属于同一种物质的有___;
(5)晶体中不含化学键的是___。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1 mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。

(1)A曲线表明,原溶液通入CO2 ________mL(标准状况)。
(2)B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为__________。
(3)原NaOH溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上被称为“世界八大公害”和“20 世纪十大环境公害”之一的洛杉矶光化学烟雾事件使 人们深刻认识到了汽车尾气的危害性。汽车尾气中氮氧化物和碳氢化合物受紫外线作用可产 生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )

A.烟雾是一种固溶胶,其分散剂是空气B.O2 和 O3 是氧的两种同素异形体
C.反应 I 属于氧化还原反应D.NO2 不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质的结构简式:
(1)2,4-二氯甲苯的结构简式为____;
(2)反-2-戊烯的结构简式为___;
(3)分子式为C6H12的某烯烃与氢气加成后得到的烷烃分子中含4个甲基,且该烯烃不存在顺反异构体,则该烯烃的一种结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH是溶液中![]() 的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸
的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸![]() 水溶液中
水溶液中![]() ,
,![]() 、
、![]() 随着溶液pH的变化曲线如图所示。下列说法 不 正 确的是
随着溶液pH的变化曲线如图所示。下列说法 不 正 确的是
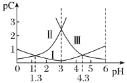
A.曲线Ⅰ代表![]() 的浓度随着pH增大先变小后变大
的浓度随着pH增大先变小后变大
B.草酸的电离常数![]() ;
;![]()
C.![]() 时,
时,![]()
D.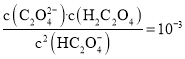
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com