
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 8.3 | 10.7 | 4.0 |
| A. | 0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少 | |
| B. | NaHCO3溶液中2c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| C. | NaHSO3溶液中c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)>c(H+)>c(OH-) | |
| D. | 向NaClO溶液中滴加硫酸至中性时,2c(SO42-)=c(HClO) |
分析 A.加水稀释,溶液中多数离子的浓度都减小,溶液中存在离子积常数,碳酸钠溶液中碳酸根离子水解显碱性,稀释溶液氢氧根离子浓度减小,氢氧根离子浓度增大;
B.NaHCO3溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),物料守恒,c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-),据此计算分析选项;
C.NaHSO3溶液中亚硫酸氢根离子电离大于水解,溶液显酸性;
D.向NaClO溶液中滴加硫酸至中性时,根据溶液中的物料守恒和电荷守恒计算分析;.
解答 解:A.碳酸钠溶液中碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,稀释Na2CO3时,碳酸根离子、碳酸氢根、氢氧根离子的浓度变小,因Kw不变,则氢离子的浓度增大,故A错误;
B.NaHCO3溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),物料守恒,c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-),计算得到离子浓度的关系为:c(H2CO3)+c(H+)=c(OH-)+c(CO32-),故B错误;
C.亚硫酸氢钠溶液呈酸性,HSO3-的电离程度大于水解程度,则c(H2SO3)<c(SO32-),溶液中离子浓度大小为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(H2SO3)>c(OH-),故C错误;
D.向NaClO溶液中滴加硫酸至中性时,c(H+)=c(OH-),电荷守恒c(H+)+c(Na+)=c(ClO-)+2c(SO42-)+c(OH-),物料守恒c(Na+)=c(ClO-)+c(HClO),所以得2c(SO42-)=c(HClO),故D正确;
故选D.
点评 本题考查了盐类水解,离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,再结合物料守恒、电荷守恒解答,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 12g C和32g O2所具有的总能量大于44g CO2所具有的总能量 | |
| B. | 12g C所具有的能量一定高于28g CO所具有的能量 | |
| C. | 56g CO和32g O2所具有的总能量大于88gCO2所具有的总能量 | |
| D. | 将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
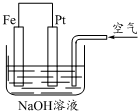 下列有关如图所示装置的叙述中错误的是( )
下列有关如图所示装置的叙述中错误的是( )| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
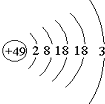 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In为过渡金属元素 | ||
| C. | In容易导电导热 | D. | In在反应中容易失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加足量的NaOH溶液后,过滤洗涤灼烧,最终固体为72g | |
| B. | 加入过量稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1648.7 kJ.mo1-1 | B. | -1255.3 kJ.mol-1 | ||
| C. | -861.7 kJ.mol-l | D. | +867.1 kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2SO2(g)+O2?2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol-1,则任何酸碱中和的反应热均为57.3kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2;则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com