
【题目】Ⅰ、(1)惰性电极电解硫酸铜溶液的化学方程式_____________________________。
(2)惰性电极电解饱和食盐水的化学方程式_____________________________。
Ⅱ、某小组同学认为,如果模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

(3)该电解槽的阳极反应式为________________________________。此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(4)制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”或“D”)导出。
(5)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为____________________________________________________。
【答案】 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 2NaCl+2H2O
2Cu+O2↑+2H2SO4 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 4OH--4e-===2H2O+O2↑ 小于 D O2+2H2O+4e-===4OH-
2NaOH+H2↑+Cl2↑ 4OH--4e-===2H2O+O2↑ 小于 D O2+2H2O+4e-===4OH-
【解析】试题分析:Ⅰ、(1)惰性电极电解硫酸铜溶液的生成Cu、O2、H2SO4;(2)惰性电极电解饱和食盐水生成氢氧化钠、氢气、氯气;Ⅱ、(3)阳极OH-失电子发生氧化反应生成氧气;通过阴离子交换膜的离子是SO42-,通过阳离子交换膜的离子是K+;(4)阴极反应生成![]() ,所以氢氧化钾溶液在阴极生成;(5)氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,正极是氧气得电子生成OH-。
,所以氢氧化钾溶液在阴极生成;(5)氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,正极是氧气得电子生成OH-。
解析:Ⅰ、(1)惰性电极电解硫酸铜溶液的生成Cu、O2、H2SO4,总反应是2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;(2)惰性电极电解饱和食盐水生成氢氧化钠、氢气、氯气,总反应是2NaCl+2H2O
2Cu+O2↑+2H2SO4;(2)惰性电极电解饱和食盐水生成氢氧化钠、氢气、氯气,总反应是2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;Ⅱ、(3)阳极OH-失电子发生氧化反应生成氧气,阳极反应式为4OH--4e-===2H2O+O2↑;通过阴离子交换膜的离子是SO42-,通过阳离子交换膜的离子是K+,根据电荷守恒通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;(4)阴极反应生成
2NaOH+H2↑+Cl2↑;Ⅱ、(3)阳极OH-失电子发生氧化反应生成氧气,阳极反应式为4OH--4e-===2H2O+O2↑;通过阴离子交换膜的离子是SO42-,通过阳离子交换膜的离子是K+,根据电荷守恒通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;(4)阴极反应生成![]() ,所以氢氧化钾溶液在阴极生成,制得的氢氧化钾溶液从出口D放出;(5)氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,正极是氧气得电子生成OH-,正极的反应式为O2+2H2O+4e-===4OH-。
,所以氢氧化钾溶液在阴极生成,制得的氢氧化钾溶液从出口D放出;(5)氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,正极是氧气得电子生成OH-,正极的反应式为O2+2H2O+4e-===4OH-。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】X和Y两元素组成化合物A和B,A的化学式为XY2,其中X占44.1%,B中X占34.5%,则B的化学式为( )
A.X2YB.XYC.XY3D.X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是
A. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32 -)>c(HCO3- )>c(OH-)
B. CH3COOH溶液加水稀释,溶液中![]() 不变
不变
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D. 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B. 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C. 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D. 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在()中填写所使用除杂试剂的化学式_____、____、_____、_____、_____,在![]() 中填写实验操作名称_____、_____、_____。
中填写实验操作名称_____、_____、_____。
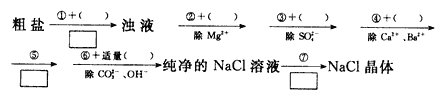
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融) ![]() 2Na+Cl2↑。已知A、B、C、D、E有如下转化关系:
2Na+Cl2↑。已知A、B、C、D、E有如下转化关系:

(1)写出A、B生成NaCl的化学方程式:_____________________________________。
(2)写出化学式:C______________,D_____________。
(3)工业生产中常利用B与Ca(OH)2反应来制备漂白粉,漂白粉的主要成分是_______________________________。(写化学式)
(4)若把A投入盛有D的溶液中,溶液中出现________________(填沉淀颜色)沉淀,该过程所发生反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VmLAl2(SO4)3 溶液中含SO42- ag,取V/4mL溶液稀释到4VmL,则稀释后溶液Al3+中的物质的量浓度是
A. 125a/(576V) mol/L B. 125a/(288V)mol/L
C. 125a/(144V )mol/L D. 125a/(96V)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com