
| A. | 200mL | B. | 300mL | C. | 490mL | D. | 720mL |
分析 发生反应HCl+NaOH=NaCl+H2O,可知HCl与NaOH按物质的量1:1进行反应,设HCl溶液的物质的量浓度为cmol/L,则25ml×cmol/L=20ml×0.125mol/L,故c=0.1mol/L,则250ml溶液中n(HCl)=0.1mol/L×0.25L=0.025mol,根据氯原子守恒,n(Cl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}×$0.025mol=0.0125mol,V(Cl2)=0.0125mol×22.4L/mol=280ml,n(O2)=500ml-280ml=220ml,并据H2+Cl2=2HCl,2H2+O2=2H2O,此方程式中氧气,氯气的量求消耗氢气的体积.
解答 解:发生反应HCl+NaOH=NaCl+H2O,可知HCl与NaOH按物质的量1:1进行反应,设HCl溶液的物质的量浓度为cmol/L,则25ml×cmol/L=20ml×0.125mol/L,故c=0.1mol/L,则250ml溶液中n(HCl)=0.1mol/L×0.25L=0.025mol,根据氯原子守恒,n(Cl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}×$0.025mol=0.0125mol,V(Cl2)=0.0125mol×22.4L/mol=280ml,n(O2)=500ml-280ml=220ml,
H2+Cl2=2HCl
280ml 280ml
2H2+O2=2H2O
440ml 220ml
故通入氢气的体积为280ml+440ml=720ml,故选D.
点评 本题考查混合物计算,侧重对解题方法技巧与学生思维能力的考查,转移利用原子守恒及电子转移守恒解答,难度中等.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:实验题
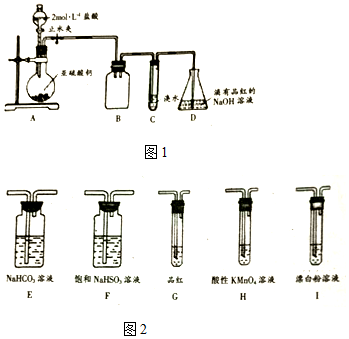
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性氧化物:CO2、SO2、H2O | B. | 碱性氧化物:Na2O、CaO、P2O5 | ||
| C. | 碱:NaOH、KOH、Ba(OH)2 | D. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
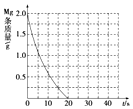
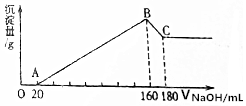 将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.
将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D | E | F | G | H |
| 原子半 径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要 化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液,可制得金属镁 | |
| B. | 测定氢氧化钠是离子化合物时,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| C. | 向FeCl3溶液中加入Mg粉,可观察到有气泡产生 | |
| D. | 在某钠盐溶液中加入澄清石灰水,若有白色沉淀生成,则该钠盐一定是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
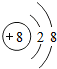 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式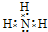 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验 编号 | 温度(K) | 盐酸浓度/ (mol•L-1) | 醋酸浓度/ (mol•L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究温度 对镁与盐酸反应速率的影响; II.实验a和c是探究浓度 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+H2O+CO2=NH4HCO3 | |
| B. | 2NH3+CO2$\frac{\underline{\;180-200℃\;}}{15-30MPa}$ CO(NH2)2+H2O | |
| C. | 8NH3+3Cl2═N2+6NH4Cl | |
| D. | 2NH3+2O2$\frac{\underline{\;一定条件\;}}{\;}$NH4NO3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com