
NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A.常温下,1 L 0.1 mol·L-1 NH4NO3溶液中的氮原子数为0.2NA
B.含有58.5 g氯化钠的溶液中含有NA个氯化钠分子
C.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
D.常温常压下,22.4 L乙烯中C—H的个数为4NA
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。根据甲、乙的摩尔质量(M)的关系判断,下列说法中正确的是( )
A.若M(甲)<M(乙),则分子数:甲<乙
B.若M(甲)>M(乙),则气体摩尔体积:甲<乙
C.若M(甲)<M(乙),则气体的压强:甲>乙
D.若M(甲)>M(乙),则气体的体积:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA( )
(2)0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA( )
(3)1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA( )
(4)1 mol Na2O2与足量CO2充分反应转移的电子数为2NA( )
(5)向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA( )
(6)1 mol Cl2参加反应转移电子数一定为2NA( )
查看答案和解析>>
科目:高中化学 来源: 题型:
某种元素原子的质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A.由已知信息可得NA=
B.W g该原子的物质的量一定是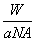 mol
mol
C.W g该原子中含有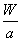 个该原子
个该原子
D.该原子的摩尔质量是aNA g
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol N2与足量的H2反应,转移的电子数是0.6NA
B.常温下,0.1 mol·L-1 NH4NO3溶液中含有的氮原子数是0.2NA
C.常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA
D.2.24 L CO和CO2的混合气体中所含的碳原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在100 g浓度为c mol·L-1、密度为ρ g·cm-3的硫酸中加入一定量的水稀释成 mol·L-1的硫酸,则加入水的体积________ 100 mL(填“=”、“>”或“<”,下同)。
mol·L-1的硫酸,则加入水的体积________ 100 mL(填“=”、“>”或“<”,下同)。
(2)若把(1)中的H2SO4改成氨水,应加入水的体积________________________________________________________________________
100 mL。
(3)若把(1)(2)中的物质的量的浓度均改为溶质的质量分数,则加入水的体积________ 100 mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com