
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
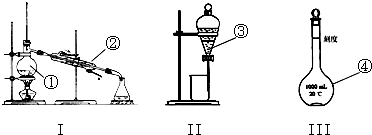
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子在反应中得到的电子数比Y原子在反应中得到的电子数少 | |
| B. | 气态氢化物 Y比X稳定 | |
| C. | X的最高正价比Y的最高正价高 | |
| D. | X单质能与Y的氢化物反应生成Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确量取20.00mL高锰酸钾溶液,可选用25 mL碱式滴定管 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol电子转移时,阴极析出6.4g金属 | |
| D. | CuSO4 的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
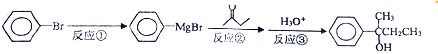
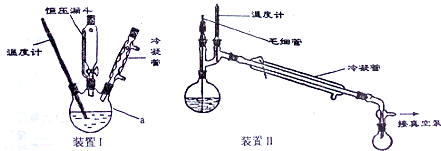
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
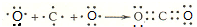 .
.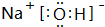 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ba(OH)2溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | Al(OH)3沉淀中滴加盐酸 Al(OH)3+3H+═Al3++3H2O | |
| D. | FeCl2溶液中通入Cl2:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com