



科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
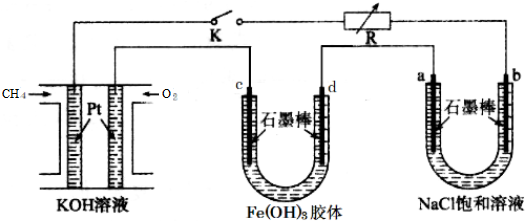
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| B、原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 |
| C、金属发生化学腐蚀还是电化学腐蚀的主要区别在于金属的纯度不同 |
| D、无论哪种类型的腐蚀,其实质都是金属被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与水反应时增大水的用量 |
| B、将铝片改为铝粉,做铝与氧气反应的实验 |
| C、在K2SO4与BaCl2两溶液反应时,增大压强 |
| D、Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成分子晶体的微粒一定含有共价键 |
| B、完全由非金属元素组成的化合物不一定是共价化合物 |
| C、H2O是一种非常稳定的化合物,这是由于氢键所致 |
| D、所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com