
LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为____________________。
(2)电池正极发生的电极反应为
________________________________________________________________________。
科目:高中化学 来源: 题型:
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
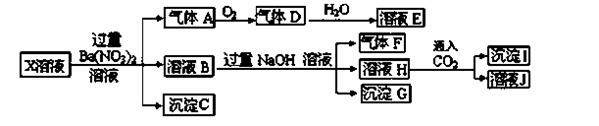 下列说法正确的是
下列说法正确的是
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 A13+和C1―
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下图所示化合物的说法不正确的是
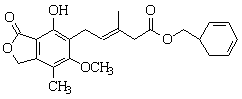
A.既可以加成反应,又可以发生取代反应
B.1 mol该化合物最多可以与5mol NaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有关化学用语的理解错误的是( )
A.电子式H: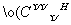 :H可以表示甲基,但是不可以表示CH
:H可以表示甲基,但是不可以表示CH
B.离子结构示意图 可以表示32S2-,又可以表示34S2-
可以表示32S2-,又可以表示34S2-
C.比例模型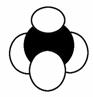 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
D.分子式C3H8O既可以表示1-丙醇,也可以表示2-丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图所示的四个原电池装置,其中结论正确的是 ( )
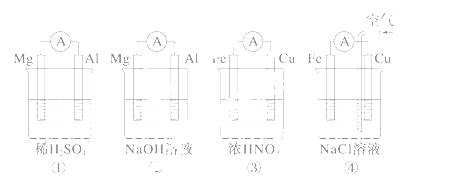
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
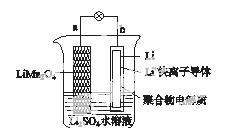
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的化合物所放出的热量。下列说法正确的是
( )。
A.通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+ O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
B.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol -1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D.已知:①C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)===CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,金刚石)===C(s,石墨) ΔH=-1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
水是生命之源,下列关于水的表达正确的是( )
A.H2O分子的比例模型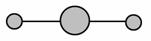
B.H2O和D2O互为同分异构体
C.H2O分子和H2O2分子都含有极性共价键和非极性共价键
D.H2O沸点高于H2S,是因为H2O分子间存在氢键作用,而H2S分子间不存在氢键作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com