
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是
A.呈弱酸性,使石蕊试液显浅红色 B.分子中的13个原子有可能处于同一平面
C.可以和NaHCO3溶液反应产生气体 D.能与FeCl3溶液反应生成紫色沉淀a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA
B. 将100 mL 0.1 mol·L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
C. CO2通过Na2O2使其增重a g时,反应中转移的电子数为![]() NA
NA
D. 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制500 mL 0.2 mol/LNaOH溶液需要的NaOH质量是多少?
(2)取上述溶液20 mL稀释成100 mL后其物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
①高铁酸钾中铁元素的化合价为________,据此推测它具有的化学性质是____________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO![]() +3Cl-+5H2O,还原剂是_____________。
+3Cl-+5H2O,还原剂是_____________。
③高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________________。
(2)某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入![]() ,然后再加过量的氨水,过滤;
,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________;加入![]() 的主要目的是________________。
的主要目的是________________。
③步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
④若要检验溶液中的![]() ,则应该加入________________试剂。
,则应该加入________________试剂。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图装置及药品进行酸性强弱的实验,下列说法不正确的是
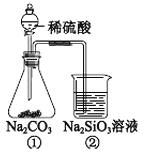
A. ①和②中发生的反应均为复分解反应
B. 若将实验中的稀硫酸换成稀盐酸也能比较三种酸强弱
C. 一段时间后②中有胶冻状物质生成
D. 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成尿素的第一步反应在高温、高压、超临界态的二氧化碳与氨反应生成甲胺,在2 L的密闭容器中发生反应:CO2 (g) + 2NH3 (g)![]() NH4COONH2 (g) ΔH=" -117.2" KJ/mol 。下列措施能提高NH3转化率的是( )
NH4COONH2 (g) ΔH=" -117.2" KJ/mol 。下列措施能提高NH3转化率的是( )
A. 升高温度 B. 通入过量的CO2
C. 通入过量的NH3 D. 使用高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)步骤Ⅰ中所用的试剂是______________。
(2)步骤Ⅲ中反应的离子方程式是_________________。
(3)步骤Ⅴ可选用的试剂是__________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤Ⅵ的实验操作是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
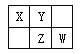
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com