
将SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中的作用是( )
A.酸 B.漂白剂 C.还原剂 D.氧化剂
科目:高中化学 来源:2013-2014学年山东省青岛市高三3月统一质量检测理综化学试卷(解析版) 题型:填空题
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 ???????????????????????????????????? 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是????? (填序号)
A.Ba(NO3)2? ???? B.BaCl2? ?? ? C.Ba(OH)2??? ???? D.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为?????????????????????????? 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作??????? 极(填“正”“负”“阴”或“阳”),其电极反应式为??????? ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为?????????? ,请判断T?????? 25℃(填“>”“<”“=”)。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三上学期期末考试化学试卷(解析版) 题型:实验题
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.
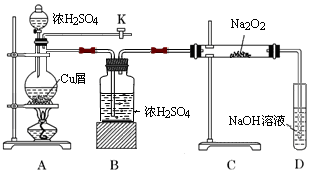
(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是 。
(2)B装置的作用是 。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
①停止加热后,再通入N2至整套装置冷却,其目的是 。
②取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有 。
③D装置中发生反应的离子方程式是 。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
a.Cu b. CuO c.CuS d.Cu2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com