
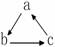
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | HNO2 | CH2=CH2 | NaOH | Fe |
| b | NO | CH3CH2Br | NaHCO3 | FeCl3 |
| c | NO2 | CH3CH2OH | Na2CO3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生:稀HNO2$\stackrel{△}{→}$NO$\stackrel{氧气}{→}$NO2无法转化为HNO2;
B.CH2=CH2与HBr发生加成反应可生成CH3CH2Br,CH3CH2Br发生水解可生成CH3CH2OH,CH3CH2OH发生消去反应可生成CH2=CH2;
C.氢氧化钠与过量二氧化碳生成碳酸氢钠,碳酸氢钠受热分解生成碳酸钠,碳酸钠与氢氧化钙反应生成氢氧化钠;
D.铁可与氯气反应生成FeCl3,FeCl3与铁反应生成FeCl2,FeCl2发生置换反应可生成Fe.
解答 解:A.亚硝酸不稳定,易发生:2HNO2$\frac{\underline{\;△\;}}{\;}$NO↑+NO2↑+H2O,浓HNO3$\stackrel{铜}{→}$NO2,NO2与水发生反应:3NO2+H2O═2HNO3+NO,NO2$\stackrel{水}{→}$NO,NO2无法转化为HNO2,不可以按图转化,故A错误;
B.可通过CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH、{H}_{2}O}{→}$CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2实现该反应,故B正确;
C.氢氧化钠与过量二氧化碳生成碳酸氢钠,碳酸氢钠受热分解生成碳酸钠,碳酸钠与氢氧化钙反应生成氢氧化钠,可以实现上述转化,故C正确;
D.可通过Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{铁}{→}$FeCl2$\stackrel{锌}{→}$Fe实现该反应,故D正确;
故选A.
点评 本题考查元素化合物知识,题目难度不大,本题注意把握常见元素化合物的性质,掌握物质性质是解题关键.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将pH=5的CH3COOH溶液稀释100倍 | |
| B. | 0.05mol/L H2SO4与0.10mol/L NaOH溶液以等体积混合 | |
| C. | pH=2的盐酸和pH=12的氨水两种溶液以等体积混合 | |
| D. | pH=1的H2SO4与0.10mol/L 的Ba(OH)2溶液以等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;CCH3OH;D
;CCH3OH;D ;ECH3COOH.
;ECH3COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q 与 W不能形成 10电子、14电子、18 电子分子 | |
| B. | Y 的最高价氧化物对应水化物的化学式只能表示为 H4YO4 | |
| C. | Y、Z、Q 分别与 X 化合,只能形成 AB2型化合物 | |
| D. | X、Z、W 中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 改变压强(压缩气体或扩大容积),平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2min的平均速率v(SO2)=0.05mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10mol•L-1NO2和0.20mol•L-1SO2,达到平衡时c(NO)与原平衡不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
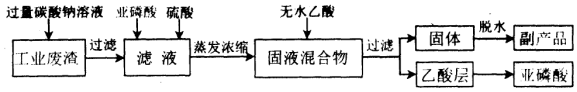
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com