

分析 (1)“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①负极上燃料失电子发生氧化反应;
②根据电池反应式中KOH是否参加反应确定溶液pH变化;
③c电极上氯离子放电生成氯气;根据转移电子相等计算消耗氧气体积;根据“析出什么加入什么”的原则确定加入物质.
解答 解:(1)根据原子经济知,Ⅰ没有副产物,符合原子经济理念,Ⅱ中有副产物,不符合原子经济理念,
故答案为:I;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
依据盖斯定律计算:①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1 ;
故答案为:-442.8kJ•mol-1 ;
(3)①醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
②反应过程中消耗氢氧根离子,溶液pH减小,
故答案为:减小;
③c电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,乙中电池反应式为2NaCl+2H2O=2NaOH+Cl2↑+H2↑,溶液中生成n(NaOH)=0.1mol/L×0.3L=0.03mol,转移电子的物质的量=0.03mol,串联电路中转移电子相等,所以消耗氧气体积=$\frac{0.03mol}{4}$=168mL;甲中阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成铜,n(CuSO4)=0.25L×0.04mol/L=0.01mol,铜离子完全放电时转移电子0.02mol<0.03mol,所以阴极上还有部分氢气生成,所以相当于析出CuO和水,可以加入CD使溶液恢复原状,故选CD,
故答案为:2Cl--2e-=Cl2↑;168;CD.
点评 本题考查了化学平衡的影响因素分析判断,平衡常数计算应用,盖斯定律的计算应用,原电池电极反应的书写方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
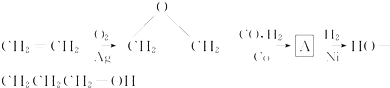
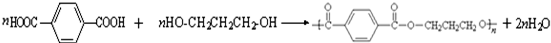 .
.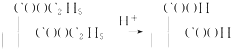 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.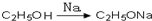 、
、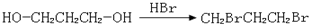 、
、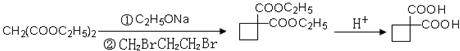 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
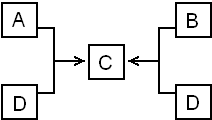 已知A与盐酸反应生成B和氢气.根据右图回答下列问题:
已知A与盐酸反应生成B和氢气.根据右图回答下列问题: ;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O.
;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集气瓶中气体的颜色不变 | B. | 集气瓶中有火星出现 | ||
| C. | 集气瓶内壁上有油状液体出现 | D. | 集气瓶口有棕黄色烟出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 糖类、油脂、蛋白质都能发生水解反应 | |
| D. | 油脂有油和脂肪之分,都属于酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法.其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子.如C2H6离子化后可得到C2H6+、C2H5+、C2H4+…,然后测定其质荷比.某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法.其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子.如C2H6离子化后可得到C2H6+、C2H5+、C2H4+…,然后测定其质荷比.某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )| A. | 甲醇 | B. | 甲烷 | C. | 丙烷 | D. | 乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com