
(6分)为了研究外界条件对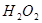 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入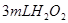 溶液,并测量收集
溶液,并测量收集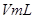 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下:
|
实验序号 |
|
|
催化剂 |
所用时间 |
|
① |
5% |
20℃ |
2滴 |
|
|
② |
5% |
40℃ |
2滴 |
|
|
③ |
10% |
20℃ |
2滴 |
|
|
④ |
5% |
20℃ |
不使用 |
|
请回答:
(1)过氧化氢分解的化学方程式是__________。
(2)实验①②是研究__________对反应速率的影响。
(3)实验测得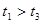 ,原因是__________。
,原因是__________。
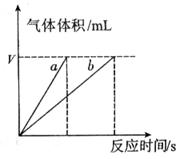
(4)实验①④的测定过程如下图,曲线a对应的实验序号是__________(填“①”或“④”)。
(1)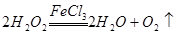 (2分,写
(2分,写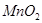 或催化剂或不写条件不扣分)
或催化剂或不写条件不扣分)
(2)温度(1分)
(3)在其他条件相同时(1分),实验③的反应物浓度大于实验①的反应物浓度,所以实验③的反应速率大于实验①的反应速率(1分)
(4)①(1分)
【解析】(1)过氧化氢在催化剂的作用下,分解生成氧气和水,方程式为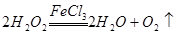 。
。
(2)实验①②中只有温度是不同的,实验研究的是温度对反应速率的影响。
(3)实验①③中只有反应物的浓度是不同放热,所以在其他条件相同时,实验③的反应物浓度大于实验①的反应物浓度,所以实验③的反应速率大于实验①的反应速率,所用时间就少。
(4)催化剂能加快反应速率,所用根据图像可知,曲线不是实验①的。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操 作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡,试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL 10%H2O2溶液. |
试管A、B中均未见气泡产生 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
| ||
| ||

查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市朝阳区高一下学期期末统一考试化学试卷(带解析) 题型:填空题
(6分)为了研究外界条件对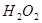 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入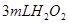 溶液,并测量收集
溶液,并测量收集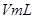 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下:
| 实验序号 | 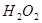 溶液浓度 溶液浓度 | 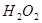 溶液温度 溶液温度 | 催化剂 | 所用时间 |
| ① | 5% | 20℃ | 2滴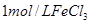 | 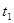 |
| ② | 5% | 40℃ | 2滴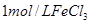 | 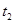 |
| ③ | 10% | 20℃ | 2滴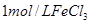 | 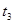 |
| ④ | 5% | 20℃ | 不使用 | 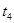 |
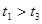 ,原因是__________。
,原因是__________。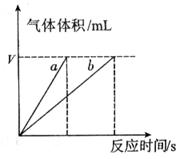
查看答案和解析>>
科目:高中化学 来源: 题型:
为了研究外界条件对![]() 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入![]() 溶液,并测量收集
溶液,并测量收集![]() 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下:
| 实验序号 |
|
| 催化剂 | 所用时间 |
| ① | 5% | 20℃ | 2滴 |
|
| ② | 5% | 40℃ | 2滴 |
|
| ③ | 10% | 20℃ | 2滴 |
|
| ④ | 5% | 20℃ | 不使用 |
|
请回答:
(1)过氧化氢分解的化学方程式是__________。
(2)实验①②是研究__________对反应速率的影响。
(3)实验测得![]() ,原因是__________。
,原因是__________。
(4)实验①④的测定过程如下图,曲线a对应的实验序号是__________(填“①”或“④”)。
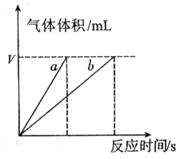
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com