A、B、C、D、E为原子序数依次增大的五种短周期元素.A、E同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D最外层电子数之和与E的核外电子总数相等.
试回答:
(1)化合物ABC中σ键和π键个数比为
1:1
1:1
,它属于
极性
极性
分子(填“极性”或“非极性”).化合物C
2A
2是一种高能量分子,且C 原子满足8 电子稳定结构.写出C
2A
2的电子式
.
(2)A、D、E 三种元素可形成一种离子化合物R,用惰性电极电解 R 的稀溶液,电解一段时间后,溶液 pH
增大
增大
(填“增大”、“减小”或“不变”).
(3)在0.1mol?L
-1E
2BD
3的溶液中,各离子浓度由大到小的顺序是
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
;分子式为 A
2B
2D
4的化合物,与等物质的量的 KOH 溶液反应后溶液呈酸性,其原因是(用文字填空)
HC2O4-的电离程度大于HC2O4-的水解程度
HC2O4-的电离程度大于HC2O4-的水解程度
.
(4)某密闭容器中发生如下反应:C
2(g)+3A
2(g)?2CA
3(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t
2、t
3、t
5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
C
C
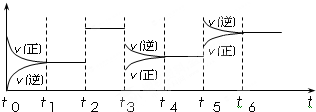
A.t
5时增大了压强 B.t
3时降低了温度
C.t
2时加入了催化剂 D.t
4~t
5时间内转化率一定最低
(5)单质A的燃烧热为akJ/mol,12gB单质燃烧生成化合物BD放出热量bkJ,1mol化合物A
2D由液态变为气态需吸收热量ckJ,写出单质B制水煤气的热化学方程式
C(s)+H2O(g)=CO(g)+H2(g)△H=(a-b-c)kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)△H=(a-b-c)kJ/mol
.







