
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
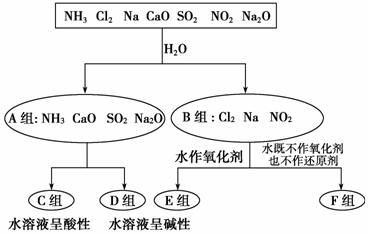
(1)上述第一级分类标准(分成A、B组的依据)是____________________________________________________________________
_________________________________________________________。
(2)F组中物质除了Cl2外,还有________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:________________________________________________________________。
(4)由Al3+制备Al(OH)3最好不选择D组中的NaOH溶液,说明理由:____________________ _________________________________________。
_________________________________________。
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似)。如:
AgX(s) Ag++X-,Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag++X-,Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s)  Ag++Y-,Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag++Y-,Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)  Ag++Z-,Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag++Z-,Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
下列说法错误的是( )
A.这三种物质在常温下溶解度最大的是AgZ
B.将AgY溶解于水后,向其中加入AgX,则c(Y-)减小
C.在25℃时,取0.188 g AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中c(Y-)=1.0×10-4 mol/L
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A+3B=4C+2D,在不同条件下反应,其平均反应速率v(X)(表示反应物的消耗速率或生成物的生成速率)如下,其中反应速率最快的是
A.v(A)=0.4mol/(L·s) B.v(B)=0.8mol/(L·s)
C.v(C)=1.2mol/(L·s) D.v(D)=0.7mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
环保部制定的《环境空气质量标准》第二次公开征求意见结束,大家普遍赞成将PM2.5(PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物)纳入常规空气质量评价,下列有关PM2.5说法不正确的是
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成气溶胶
C.实施绿化工程,可以有效地防治PM2.5污染
D.研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质分类的正确组合是
| 分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 硝酸 | 烧碱 | 氧化铝 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化铁 | 二氧化氮 |
| C | 苛性钾 | 硬脂酸 | 小苏打 | 氧化钙 | 五氧化二磷 |
| D | 苛性钠 | 石炭酸 | 硫酸铵 | 过氧化钠 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢的沸点比水高,但受热容易分解。某试剂厂先制得7~8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是( )
A.常压蒸馏 B.减压蒸馏
C.加生石灰常压蒸馏 D.加压蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。下列有关叙述正确的是( )
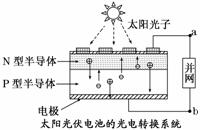
A.光伏电池是将太阳能转变为电能
B.光伏电池是将化学能转变为电能
C.电流从a流向b
D.图中N型半导体为正极,P型半导体为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反 应方程式:__________________________________________________。
应方程式:__________________________________________________。
 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为________________________________,正极的反应式为________________。理想状态下,该燃料电池消耗1 mol 甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,10 mL0.1mol·L-1的氨水加水稀释后,下列说法正确的是
A.溶液的pH增大
B.溶液中NH4+和OH—离子的数目减少
C.NH3·H2O的电离程度增大,c(H+)也增大
D.加入适量盐酸使c(NH+4)=c(Cl—),混合液的pH<7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com