
分析 (1)注明物质的聚集状态与反应热书写热化学方程式;
(2)计算氢气、CO、甲烷的物质的量,结合燃烧热计算放出的热量;
(3)根据方程式计算氢气、CO、甲烷消耗氧气体积,再计算需要氧气总体积,结合空气中氧气含量计算需要空气体积;
(4)计算1kg 20℃的水加热至沸腾需要的热量,结合(2)中1L煤气燃烧放出的热量计算.
解答 解:(1)1mol H2完全燃烧生成液态水放出热量285.8kJ,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,
1mol CH4完全燃烧生成CO2气体和液态水放出热量890.4kJ,甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4 kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol;
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4 kJ/mol;
(2)标准状况下的1升这种煤气中,氢气为0.48L、CO为0.15L、甲烷为0.13L,则完全燃烧放出热量为:
$\frac{0.48}{22.4}$×285.8kJ+$\frac{0.15}{22.4}$×282.8kJ+$\frac{0.13}{22.4}$×890.4kJ=13.19kJ,
答:标准状况下的1升这种煤气完全燃烧能放出13.19kJ热量.
(3)由:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,可知需要氧气体积为:
0.48L×$\frac{1}{2}$+0.15L×$\frac{1}{2}$+0.13L×2=0.575L,故需要空气体积为0.575L÷21%=2.74L,
答:需要空气体积为2.74L.
(4)1克水温度每上升1℃需要热量4.2J,则1kg 20℃的水加热至沸腾需要热量为4.2J×1000×80=336000J=336kJ,设需要消耗标准状况下的这种煤气xL,则:
x×13.19kJ×60%=336kJ
解得x=42.5,
答:需消耗标准状况下的这种煤气42.5升.
点评 本题考查燃烧热的有关计算、热化学方程式书写,侧重考查学生计算能力,题目计算量比较大,属于易错题目,注意对基础知识的理解掌握.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下生成N的体积为$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的质量为17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物质的量为$\frac{bV}{1000}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=H++NO3-+2NO | |
| B. | NaClO溶液中ClO-的水解:ClO-+H2O=HClO+OH- | |
| C. | 酸性条件下,用H2O2将I-转化为I2:H2O2+2I-+2H+=I2+2H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3与CH4互为同系物 | |
| B. | 乙醇和乙酸都能与金属钠反应 | |
| C. | 正丁烷(CH3CH2CH2CH3)与异丁烷(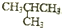 )互为同分异构体 )互为同分异构体 | |
| D. | 甲烷与苯在空气中燃烧的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由反应①②可计算出CH3OH的燃烧热 | |
| B. |  反应②中的能量变化如图所示 | |
| C. | 可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ•mol-1 | |
| D. | 可推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++SO32-+H2O | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com