
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 当转移8mol电子时,还原产物比氧化产物多1mol |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应中S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,据此分析.
解答 解:A.由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,故A正确;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,可知,转移8个电子,生成的3molNa2S2O3中1mol是氧化产物,2mol是还原产物,还原产物比氧化产物多1mol,故D正确.
故选AD.
点评 本题考查了氧化还原反应,注意根据反应物和生成物写出反应方程式,结合元素化合价的变化分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
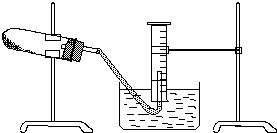 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 碳酸氢钠溶液与氢氧化钠溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与硫酸溶液反应:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓ | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | ||
| C. | (CH3)2CHCH2CH2CH(CH3)2 | D. | (CH3)2CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀豆浆、淀粉溶液、CuSO4溶液均为胶体 | |
| B. | 溶液和胶体的本质区别在于是否能产生丁达尔效应 | |
| C. | NaCl 溶液和BaSO4悬浊液的本质区别是分散质粒子的大小 | |
| D. | 直接加热饱和氯化铁溶液就可以制得氢氧化铁胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com