
| 物质 | A | B | CO | H2 |
| 燃烧热/kJ•mol-1 | 725 | 5 518 | 283 | 286 |
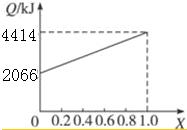
分析 (1)依据图象分析B的质量分数为100%时放热4414KJ,结合B的燃烧热是1molB完全燃烧生成稳定氧化物放出的热量计算出B的物质的量,根据摩尔质量概念计算得到;当全部是A物质放热2066KJ,结合A的燃烧热计算A的物质的量,计算摩尔质量;
(2)反应后气体通过浓硫酸后,得到104L气体是氧气和二氧化碳的混合气体,通过碱石灰吸收后剩余3.2 L,是剩余的氧气,所以生成二氧化碳为:104-3.2=100.8L,物质的量为4.5mol,消耗氧气的体积为:160 L-3.2 L=156.8L,物质的量为7mol,然后根据平均相对分子量和耗氧量列式;
(3)计算1mol等物质的量的甲醇、汽油(C8H18)混合的燃料完全燃烧放出的热量,进而计算实际燃烧损失的热量,该热量为生成的CO燃烧放出的热量,根据CO的燃烧热计算CO的物质的量.
解答 解:(1)当X=1.0燃油全部是B,根据B的燃烧热计算B的物质的量,n(B)=$\frac{4414KJ}{5518KJ/mol}$=0.7999mol;则M(B)=$\frac{91.2g}{0.7999mol}$=114g/mol;
当X=0时,燃油全部是A,依据A的燃烧热计算A的物质的量=$\frac{2066kj}{725KJ/mol}$=2.85mol,则M(A)=$\frac{91.2g}{2.85mol}$=32g/mol;
故答案为:32;114;
(2)反应后气体通过浓硫酸后,得到104L气体是氧气和二氧化碳的混合气体,通过碱石灰吸收后剩余3.2 L,是剩余的氧气,所以生成二氧化碳为:104-3.2=100.8L,物质的量为4.5mol,消耗氧气的体积为:160 L-3.2 L=156.8L,物质的量为7mol,等物质的量的A、B混合的燃料73 g,设物质的量各为xmol,即32x+114y=73,解之得x=0.5mol,所以各为1mol时混合体系的质量为:146g,消耗氧气的量为14mol,生成9mol的二氧化碳,所以平均组成中碳原子数为9,设混合气体组成为:C9HxOy,$\left\{\begin{array}{l}{12×9+x+16y=146}\\{9+\frac{x}{4}-\frac{y}{2}=14}\end{array}\right.$,解之得$\left\{\begin{array}{l}{x=22}\\{y=1}\end{array}\right.$,则平均组成为C9H22O,A、B两种物质含有C、H、O三种元素中的两种或三种,结合M(A)=32g/mol、M(B)=114,可知A的分子式为:CH4O,B的分子式为:C8H18,故答案为:9:22:1;CH4O;C8H18;
(3)0.5mol甲醇完全燃烧放出的热量为:0.5mol×725/kJ•mol-l=362.5kJ,
0.5mol汽油完全燃烧放出的热量为:0.5mol×5518/kJ•mol-l=2759kJ,
故不完全燃烧损失的热量为:362.5kJ+2759kJ-2980kJ=141.5kJ,
故生成的CO为$\frac{141.5kJ}{283kJ/mol}$=0.5mol,
故答案为:0.5.
点评 本题考查了燃烧热的概念应用和计算,主要是图象分析计算A、B的摩尔质量,混合物的综合计算,原子守恒是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 用Ag作电极电解硝酸银溶液:4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$ 4Ag+O2↑+4H+ | |
| D. | 向AgCl悬浊液中加入饱和NaI溶液反应的离子方程式:AgCl+I-═AgI+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
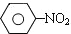 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$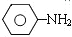 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化) $\stackrel{KMnO_{4}、H+}{→}$
$\stackrel{KMnO_{4}、H+}{→}$
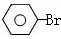 $→_{高温、加压}^{NaOH溶液、催化剂}$
$→_{高温、加压}^{NaOH溶液、催化剂}$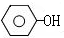
 (对氨基水杨酸钠)
(对氨基水杨酸钠)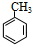 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$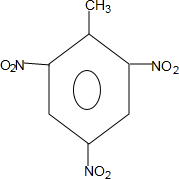 +3H2O
+3H2O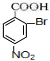 D:
D: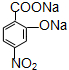 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构或 性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.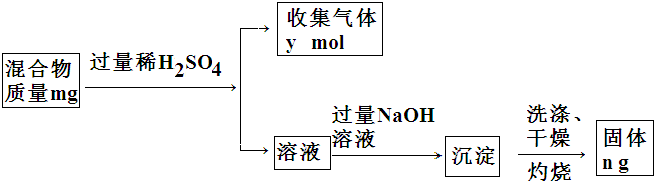
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com