
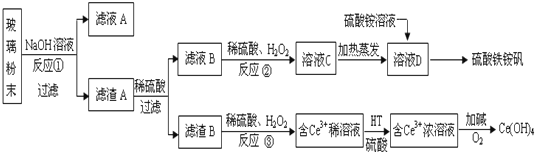
分析 废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入硫酸和氧化剂过氧化氢可生成溶液C中为硫酸铁,所加氧化剂过氧化氢不引入新杂质,加热蒸发得到溶液D为饱和硫酸铁溶液,在溶液中加入硫酸铵溶液得到硫酸铁铵矾;滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2,加入HT硫酸萃取,将Ce3+从水溶液中萃取出来,Ce3+加碱和氧气发生氧化还原反应生成Ce(OH)4,以此解答该题.
解答 解:(1)反应①是二氧化硅溶于氢氧化钠溶液中生成硅酸钠和水,反应的离子方程式是SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(2)反应②中H2O2的作用是氧化使亚铁离子为铁离子,故答案为:氧化使Fe2+转化为Fe3+;
(3)反应③是酸性溶液中CeO2被过氧化氢还原生成Ce3+离子,过氧化氢被氧化生成氧气,反应的离子方程式2GeO2+6H++H2O2=2Ge3++4H2O+O2↑,
故答案为:2GeO2+6H++H2O2=2Ge3++4H2O+O2↑;
(4)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)═2CeT3(有机层)+6H+(水层),加入硫酸增大氢离子浓度,平衡逆向进行向形成Ge3+水溶液方向移动,获得较纯的含Ce3+的水溶液;
故答案为:混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动;
(5)硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O]广泛用于水的净化处理,其净水原理是溶解后溶液中的铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,可以净水,反应的离子方程式为:Fe3++3H2O=Fe(OH)3+3H+,故答案为:Fe3++3H2O=Fe(OH)3+3H+.
点评 本题以工艺流程为基础,考查了化学实验基本操作、元素及化合物知识反应等相关知识,提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和操作方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法 | 实验现象及结论 |
| 取少量待测物于试管中,加水溶解后,滴加少量稀硫酸 | 出现无色气体溢出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
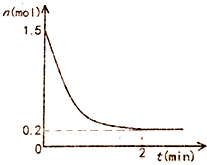 在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:
在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
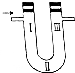 ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).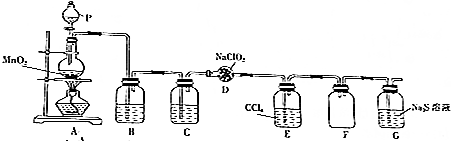
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应达到平衡后,其他的条件不变的情况下,只改变压强,平衡不移动 | |
| B. | 该反应的化学平衡常数为K=$\frac{c(C){c}^{3}(D){c}^{4}(E)}{c(A)c(B)}$ | |
| C. | E为气体 | |
| D. | 该反应的热化学方程式 2A(g)+B(g)?C(g)+3D(l)+4E(g)△H=-QkJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O | |
| B. | H2S在水溶液中的电离:H2S+H2O?H3O++HS- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+H+═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
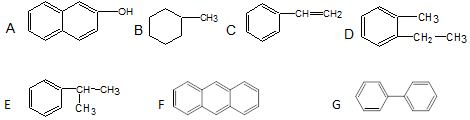
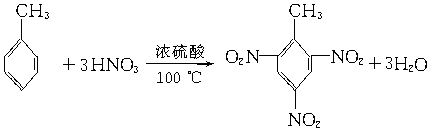 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com