随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO
2的含量及有效地开发利用CO
2,引起了各国的普遍重视.目前工业上有一种方法是用CO
2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu
2O/ZnO):
CO(g)+2H
2(g)
CH
3OH(g)
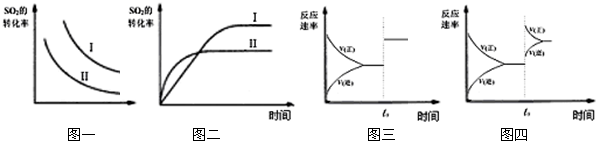
根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=
,升高温度,K值
减小
减小
(填“增大”、“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H
2)=
(用 n
B t
B 表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
,下列有关该体系的说法正确的是
bc
bc
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时
增大
(4)据研究,反应过程中起催化作用的为Cu
2O,反应体系中含少量CO
2有利于维持催化剂Cu
2O的量不变,原因是:
Cu
2O+CO
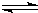
2Cu+CO
2Cu
2O+CO
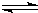
2Cu+CO
2(用化学方程式表示).
(5)使用燃料电池是节能减排的重要手段之一.CO和H
2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y
2O
3的ZrO
2晶体,它在高温下能传导O
2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H
2=CH
3OCH
3+CO
2 或 2CO+4H
2=CH
3OCH
3+H
2O.上述水煤气燃料电池的负极反应方程式:(写1个)
CO+O2--2e-=CO2 H2+O2--2e-=2H2O
CO+O2--2e-=CO2 H2+O2--2e-=2H2O
.
(6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:
CH
3OCH
3(g)+3O
2(g)
2CO
2(g)+3H
2O(l)△H=-1455kJ?mol
-1CH
3OCH
3(g)+3O
2(g)
2CO
2(g)+3H
2O(l)△H=-1455kJ?mol
-1

 9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2 (4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是
(4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题: 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):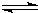 CH3OH(g)
CH3OH(g)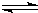 2Cu+CO2
2Cu+CO2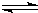 2Cu+CO2
2Cu+CO2
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题: