
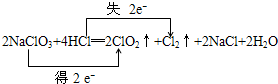
分析 (1)化合价升高元素所在的反应物是还原剂,对应产物是氧化产物;化合价降低元素所在的反应物是氧化剂,所在的产物是还原产物;
(2)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
(3)化合价降低值=化合价升高值=转移电子数;
(4)化合价升高元素在反应中被氧化;
(5)根据化学方程式转移电子的数目以及方程式的系数之间的关系来计算.
解答 解:(1)化合价升高元素Cl所在的反应物HCl是还原剂,对应产物Cl2是氧化产物;化合价降低Cl元素所在的反应物NaClO3是氧化剂,所在的产物ClO2是还原产物;
故答案为:NaClO3; Cl2;
(2)化合价升高元素所在的反应物HCl是还原剂,4mol盐酸参加反应,一半做还原剂,化合价降低Cl元素所在的反应物NaClO3是氧化剂,氧化剂与还原剂物质的量比是1:1,故答案为:1:1;
(3)反应2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,化合价升高元素Cl所在的反应物HCl,是还原剂,合价降低Cl元素所在的反应物NaClO3是氧化剂,化合价降低值=化合价升高值=转移电子数=2,电子转移如下: ,故答案为:
,故答案为: ;
;
(4)化合价升高的元素是H2O2中的O元素在反应中被氧化,故答案为:H2O2;
(5)反应2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O中,有2mol电子转移,则产生的ClO2气体2mol,若反应中有0.1mol电子转移,则产生的ClO2气体0.1mol,在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24.
点评 本题考查学生氧化还原反应中的概念以及化合价升降和电子转移知识,难度中等,注意知识的归纳和梳理是关键.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 蛋白质只含有C、H、O三种元素 | |
| C. | 油脂在碱性条件下水解可制肥皂 | |
| D. | 葡萄糖与新制氢氧化铜悬浊液共沸有砖红色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- | |
| B. | 某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水 | |
| C. | 向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含CO32-或HCO3- | |
| D. | 将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b端是直流电源的负极 | |
| B. | 实验过程中溶液的导电能力没有明显变化 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa混合液,溶液显酸性,则溶液中粒子浓度:c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-) | |
| B. | 浓度均为0.1 mol•L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)═2c(H+)+c(HA) | |
| D. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稀释前,c (A)>10 c (B) | |
| B. | 稀释前,A溶液中水电离出的OH- 浓度是B溶液中由水电离出的OH- 浓度的10倍 | |
| C. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| D. | M点时A和B的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com