
【题目】在-定体积的某密闭容器中发生合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
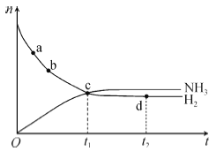
A.a点的正反应速率大于b点的
B.c点处,υ正(N2)=υ逆(N2)
C.d点处,υ正(N2):υ逆(H2)=1:3
D.升高温度,反应至t2时刻,n(H2)比图中d点的值大
【答案】B
【解析】
由图可知,随着反应的进行,反应物的量逐渐减少,生成物的量逐渐增多,达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,曲线水平,升高温度,平衡逆向移动,据此分析判断。
A. 从a点到b点,氢气的物质的量逐渐减少,浓度降低,所以正反应速率降低,即a点的正反应速率大于b点的正反应速率,A项正确;
B. c点处,n(H2)=n(NH3),但反应没有达到平衡状态,用N2表示的正、逆反应速率不相等,B项错误;
C. d点处达到平衡状态时,正反应速率等于逆反应速率,即υ正(N2):υ逆(H2)=1:3,C项正确;
D. 升高温度,平衡逆向进行,因此反应至t2时刻,n(H2)比图中d点的值大,D项正确;
答案选B。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃下,纯水中c(H+)=1×10-7 mol·L-1,则此时c(OH-)=______________,该温度下向纯水中加盐酸,使溶液中的c(H+)=1×10-3 mol·L-1,则此时溶液的pH=_______________。若25℃下,向纯水中加入NaOH固体,使溶液的pH=13,此时溶液中c(OH-)=___________。 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 ![]() NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
(2)同素异形体相互转化的反应热相当少而转化速率慢,有时还很不完全,测定时很 困难,现可依据盖斯定律进行计算。已知:
P4 (白磷,s) + 5O2 (g) = 2P2O5 (s); △H1 =-283.2 kJ·mol-1 ①
4P (红磷,s) + 5O2 (g) = 2P2O5 (s); △H2 =-184.0kJ·mol-1 ②
由热化学方程式看来,更稳定的磷的同素异形体是 ______(填“白磷”或“红磷”) ,试写出白磷转化成红磷的热化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)[Fe2(OH)n(SO4)3-0.5n]m和绿矾FeSO4·7H2O,其过程如图所示,下列说法不正确的是
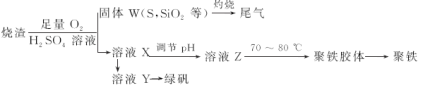
A.炉渣中FeS与硫酸、氧气反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S+6H2O
B.溶液Z加热到70~80 ℃的目的是促进Fe3+的水解
C.溶液Y经蒸发浓缩、冷却结晶、过滤等步骤可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若pH偏小导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
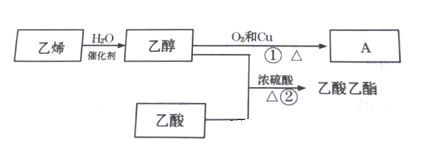
(1)A的名称为_____________;
(2)①的反应方程式___________________;①的反应类型___________;
(3)②的反应方程式_____________;②的反应类型是__________________;
(4)浓H2SO4的作用_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,不正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) H=-57.4kJmol-1
B.根据C(石量,s)=C(金刚石,s) H>0 可知石墨比金刚石稳定
C.根据2H2(g)+O2(g)=2H2O(l) H=-483.6 kJmol-l可知H2的燃烧热为241.8kJmol-1
D.由C(s)+O2(g)=CO2(g) H1,C(s)+![]() O2(g)=CO(g) H2 可知 H1>H2
O2(g)=CO(g) H2 可知 H1>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:
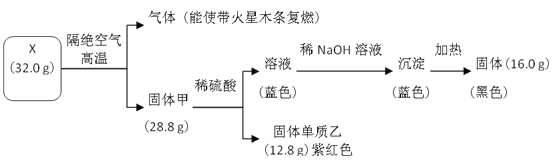
请回答:
(1)X 的化学式是______________。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________。
(3)写出固体甲与稀硫酸反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.升高温度B.增大水蒸气浓度
C.加入大量CD.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,向![]()
![]() 的醋酸溶液中加入醋酸钠晶体,若混合液的
的醋酸溶液中加入醋酸钠晶体,若混合液的![]() ,则该溶液中
,则该溶液中![]()
B.根据下表中有关共价键的键能:
共价键 |
|
|
|
|
键能 | 348 | 610 | 413 | 436 |
可以计算出反应:![]()
![]()
![]()
![]() 的
的![]()
C.一定量的复盐![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,在某一时刻,反应的离子方程式可能是
溶液,在某一时刻,反应的离子方程式可能是![]()
D.已知:![]() ,
, ,向该温度下的饱和
,向该温度下的饱和![]() 溶液中加入一定量的硫酸钠或氯化钡固体后使
溶液中加入一定量的硫酸钠或氯化钡固体后使![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com