
 £®
£®| »Æѧ¼ü | N-N | N=N | N”ŌN | N-H | H-H |
| ¼üÄÜ/kJ•mol-1 | 159 | 418 | 946 | 391 | 436 |
·ÖĪö £Ø1£©N3-Ąė×ÓŌ×ÓŗĖĶā¹²ÓŠ10øöµē×Ó£¬øł¾ŻÄÜĮæ×īµĶŌĄķæÉŠ“³öµē×ÓÅŲ¼Ź½£¬ŌŁÓĆÅŻĄūŌĄķ»³öŗĖĶāµē×ÓÅŲ¼Ķ¼£»
£Ø2£©N”ŌNÖŠŗ¬ÓŠ2øö¦Š¼ü£¬1øö¦Ņ¼ü£¬ŅŃÖŖN”ŌN¼üÄÜĪŖ942kJ/mol£¬N-Nµ„¼ü¼üÄÜĪŖ247kJ/mol£¬¼ĘĖć³ö1øö¦Š¼üµÄ¼üÄÜŌŁÅŠ¶Ļ£»
£Ø3£©»Æѧ·“Ó¦µÄŹµÖŹŹĒ¾É¼üµÄ¶ĻĮŃŗĶŠĀ¼üµÄŠĪ³É£¬·“Ó¦ČȵČÓŚ·“Ó¦Īļ×ܼüÄܼõÉś³ÉĪļ×ܼüÄÜ£®
½ā“š ½ā£ŗ£Ø1£©NŌ×ÓŌ×ÓŠņŹżĪŖ7£¬N3-Ąė×ÓŌ×ÓŗĖĶā¹²ÓŠ10øöµē×Ó£¬ĒŅ×īĶā²ć“ļµ½ĪČ¶Ø½į¹¹£¬øł¾ŻÄÜĮæ×īµĶŌĄķæÉŠ“³öµē×ÓÅŲ¼Ź½1s22s22p6£¬Ćæøö¹ģµĄ×ī¶ąÖ»ÄÜČŻÄÉĮ½øöµē×Ó£¬ĒŅ×ŌŠżĻą·“Åä¶Ō£¬ŌņÓĆ¹ģµĄ±ķŹ¾¼“ŗĖĶāµē×ÓÅŲ¼Ķ¼ĪŖ£ŗ £»
£»
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø2£©N”ŌNÖŠŗ¬ÓŠ2øö¦Š¼ü£¬1øö¦Ņ¼ü£¬ŅŃÖŖN”ŌN¼üÄÜĪŖ942kJ/mol£¬N-Nµ„¼ü¼üÄÜĪŖ247kJ/mol£¬Ōņ1øö¦Š¼üµÄ¼üÄÜĪŖ$\frac{942-247}{2}$kJ/mol=347.5kJ/mol£¬ŌņN2ÖŠµÄ¦Š¼ü¼üÄÜ“óÓŚ¦Ņ¼ü¼üÄÜ£¬½ĻĪČ¶Ø£¬
¹Ź“š°øĪŖ£ŗ¦Š£»¦Ņ£»
£Ø3£©·“Ó¦ČČ¾ĶŹĒ¶Ļ¼üĪüŹÕµÄÄÜĮæŗĶŠĪ³É»Æѧ¼üĖł·Å³öµÄÄÜĮæµÄ²īÖµ£¬¶ŌÓŚ·“Ó¦N2£Øg£©+3H2£Øg£©=2NH3£Øg£©£¬
·“Ó¦ČČ”÷H=3”Į436 kJ/mol+946kJ/mol-2”Į3”Į391kJ/mol=-92kJ/mol£¬¼“ČČ»Æѧ·½³ĢŹ½ŹĒN2£Øg£©+3H2£Øg£©=2NH3£Øg£©”÷H=-92kJ/mol£¬
¹Ź“š°øĪŖ£ŗN2£Øg£©+3H2£Øg£©=2NH3£Øg£©”÷H=-92kJ•mol-1£®
µćĘĄ ±¾Ģāæ¼²éĮĖŗĖĶāµē×ÓÅŲ¼Ķ¼µÄŹéŠ“”¢»Æѧ¼üµÄĪČ¶ØŠŌÅŠ¶Ļ”¢ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£¬ÄѵćŹĒ»Æѧ¼üĪČ¶ØŠŌµÄÅŠ¶Ļ£¬²ąÖŲ¶ŌѧɜÄÜĮ¦µÄÅąŃų£¬ŅāŌŚ¹®¹ĢѧɜµÄ»ł“”£¬ĢįøßѧɜµÄ“šĢāÄÜĮ¦ŗĶѧĻ°Š§ĀŹ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ijČÜŅŗÖŠµĪ¼ÓAgNO3ČÜŅŗÓŠ°×É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠCl- | |
| B£® | ijČÜŅŗĻČ¼Ó×ćĮæŃĪĖįĪŽĻÖĻó£¬ŌŁµĪ¼ÓBaCl2ČÜŅŗÓŠ°×É«³Įµķ£¬ŌņŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠSO42- | |
| C£® | ijĪŽÉ«ČÜŅŗµĪČė·ÓĢŖĻŌŗģÉ«£¬øĆČÜŅŗÖŠŅ»¶Øŗ¬ÓŠ“óĮæµÄH+ | |
| D£® | ijČÜŅŗÖŠµĪ¼ÓĻ”ĮņĖįÉś³ÉĪŽÉ«ĘųĢ壬ĖµĆ÷ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠCO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
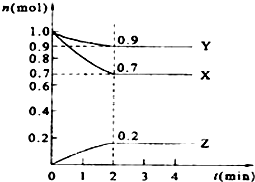 ijĪĀ¶ČŹ±£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£®
ijĪĀ¶ČŹ±£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 äåŅŅĶéŹĒŅ»ÖÖÖŲŅŖµÄÓŠ»ś»Æ¹¤ŌĮĻ£¬Ęä·ŠµćĪŖ38.4”ę£®ÖʱøäåŅŅĶéµÄŅ»ÖÖ·½·ØŹĒŅŅ“¼ÓėĒāäåĖį·“Ó¦£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒCH3CH2OH+HBr$”ś_{”÷}^{ÅØĮņĖį}$CH3CH2Br+H2O£®
äåŅŅĶéŹĒŅ»ÖÖÖŲŅŖµÄÓŠ»ś»Æ¹¤ŌĮĻ£¬Ęä·ŠµćĪŖ38.4”ę£®ÖʱøäåŅŅĶéµÄŅ»ÖÖ·½·ØŹĒŅŅ“¼ÓėĒāäåĖį·“Ó¦£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒCH3CH2OH+HBr$”ś_{”÷}^{ÅØĮņĖį}$CH3CH2Br+H2O£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶųŹÜµ½¹Ų×¢£¬ĻĀ±ķĪŖÖĘČ”Cu2OµÄČżÖÖ·½·Ø£ŗ
ÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶųŹÜµ½¹Ų×¢£¬ĻĀ±ķĪŖÖĘČ”Cu2OµÄČżÖÖ·½·Ø£ŗ| ·½·Ø¢ń | ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuO |
| ·½·Ø¢ņ | µē½ā·Ø£¬·“Ó¦ĪŖ2Cu+H2O $\frac{\underline{\;µē½ā\;}}{\;}$ Cu2O+H2”ü£® |
| ·½·Ø¢ó | ÓĆėĀ£ØN2H4£©»¹ŌŠĀÖĘCu£ØOH£©2 |
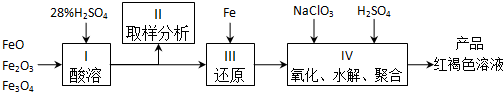
| ŠņŗÅ | ĪĀ¶Č | 0 | 10 | 20 | 30 | 40 | 50 |
| ¢Ł | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ¢Ś | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ¢Ū | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ęū³µĪ²ĘųŹĒ³ĒŹŠµÄÖ÷ŅŖæÕĘųĪŪČ¾Īļ£¬ŃŠ¾ææŲÖĘĘū³µĪ²Ęų³ÉĪŖ±£»¤»·¾³µÄŹ×ŅŖČĪĪń£®ŌŚĘū³µÉĻ°²×°ČżŠ§“ß»Æ×Ŗ»ÆĘ÷£¬æÉŹ¹Ęū³µĪ²ĘųÖŠµÄÖ÷ŅŖĪŪČ¾Īļ½ųŠŠĻą»„·“Ó¦£¬Éś³ÉĪŽ¶¾ĪļÖŹ£»»ņÕߏ¹ÓĆŠĀŠĶČ¼ĮĻµē³Ų×÷Ęū³µ¶ÆĮ¦£¬¼õÉŁĘū³µĪ²ĘųĪŪČ¾£®
Ęū³µĪ²ĘųŹĒ³ĒŹŠµÄÖ÷ŅŖæÕĘųĪŪČ¾Īļ£¬ŃŠ¾ææŲÖĘĘū³µĪ²Ęų³ÉĪŖ±£»¤»·¾³µÄŹ×ŅŖČĪĪń£®ŌŚĘū³µÉĻ°²×°ČżŠ§“ß»Æ×Ŗ»ÆĘ÷£¬æÉŹ¹Ęū³µĪ²ĘųÖŠµÄÖ÷ŅŖĪŪČ¾Īļ½ųŠŠĻą»„·“Ó¦£¬Éś³ÉĪŽ¶¾ĪļÖŹ£»»ņÕߏ¹ÓĆŠĀŠĶČ¼ĮĻµē³Ų×÷Ęū³µ¶ÆĮ¦£¬¼õÉŁĘū³µĪ²ĘųĪŪČ¾£®
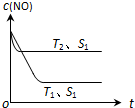
| Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 |
| c £ØNO£©£Ø”Į10-3 mol•L-1£© | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
| c £ØCO£©£Ø”Į10-3 mol•L-1£© | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ų±š½ŗĢåÓė×ĒŅŗ£Ø¶”“ļ¶ūŠ§Ó¦£© | B£® | øßŃ¹³ż³¾£ØµēÓ¾ĻÖĻó£© | ||
| C£® | ŗÓŗ£½»»ć“¦æɳĮ»żÉ³ÖŽ£Ø¾Ū³Į£© | D£® | ÅēĪķ¼ĮµÄÓ¦ÓĆ£Ø²¼ĄŹŌĖ¶Æ£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com