
【题目】二茂铁[(C5H5)2Fe](橙黄色粉末,不溶于水,易溶于乙醚等有机溶剂)及其衍生物在工业、农业、医药、航天、节能、环保等行业具有广泛地应用。某校课外小组依据反应2KOH+2C5H6+FeCl2=(C5H5)2Fe+2KCl+2H2O在绝对无水、无氧的条件下制备二茂铁。
回答下列问题:
(1)甲组同学拟制备无水FeCl2,主要实验流程为:

步骤I用饱和Na2CO3溶液浸泡的目的是_______;步骤II 中铁屑是过量的,其目的是_____;步骤IV脱水的方法是____________。
(2)乙组用环戊二烯二聚体(沸点为174℃)制备环戊二烯(沸点为419℃),已知:(C5H6)2(环戊二烯二聚体)![]() 2C5H6(环戊二烯)。分离得到环戊二烯的操作方法为________。
2C5H6(环戊二烯)。分离得到环戊二烯的操作方法为________。
(3)丙组同学制备二茂铁的装置如图所示(夹持装置已略去)。

已知:二甲基亚砜的结构式为 ,热稳定性好,能溶解大多数有机物。
,热稳定性好,能溶解大多数有机物。
①图中冷却水从接口______进入(填“a”或“b”)。
②装药品前及整个过程需通入干燥的A,装药品前通入N2的目的是_________。
③反应后分离出上层橙黄色乙醚清液,先用盐酸洗涤,其目的是_______;再用水洗,水洗时能说明已洗涤干净的依据是_________;洗涤后得到的二茂铁乙醚溶液获得二茂铁固体可采用的操作方法是_____________。
【答案】 除去铁屑表而的油污 确保反应后的液体中不含Fe3+ 在HCl气流中加热脱水 蒸馏 a 排尽装置内空气 除去产品中溶解的KOH 取最后一次洗涤液水层中液体少许于试管中,滴入硝酸酸化的AgNO3溶液,无白色沉淀产生 蒸发结晶
【解析】(1)铁屑表面有油污,用饱和Na2CO3溶液浸泡可除去;Fe2+易被氧化为Fe3+,为防止溶液中含有Fe3+,步骤II中应使铁屑过量还原Fe3+;为防止氯化亚铁晶体在加热时发生水解,步骤IV脱水的方法是在HCl气流中加热脱水;综上,本题正确答案是: 除去铁屑表而的油污; 确保反应后的液体中不含Fe3+ ; 在HCl气流中加热脱水。
(2)已知:(C5H6)2(环戊二烯二聚体)![]() 2C5H6(环戊二烯),结合信息:环戊二烯二聚体(沸点为174℃)和环戊二烯(沸点为419℃),分离沸点不同的液体混合物的方法为蒸馏,因此,本题正确答案为:蒸馏。
2C5H6(环戊二烯),结合信息:环戊二烯二聚体(沸点为174℃)和环戊二烯(沸点为419℃),分离沸点不同的液体混合物的方法为蒸馏,因此,本题正确答案为:蒸馏。
(3)①在蒸馏装置中,冷凝管的冷凝水要从下口进上口出,故选a;
②由信息知:制备二茂铁需要在绝对无水、无氧的条件下,因此装药品前通入N2以排尽装置内空气;
③上层橙黄色乙醚清液,先用盐酸洗涤,可除去产品中溶解的KOH;再用水洗,可除去过量的盐酸,检验是否洗涤干净,可检查滤液中是否含有Cl-,采用的方法是:取最后一次洗涤液水层中液体少许于试管中,滴入硝酸酸化的AgNO3溶液,无白色沉淀产生,则说明洗涤干净;由于二茂铁易溶于乙醚,乙醚易挥发,故可采用蒸发结晶的操作方法;综合以上分析:本题正确答案为: 除去产品中溶解的KOH ;取最后一次洗涤液水层中液体少许于试管中,滴入硝酸酸化的AgNO3溶液,无白色沉淀产生; 蒸发结晶


科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化。试回答:
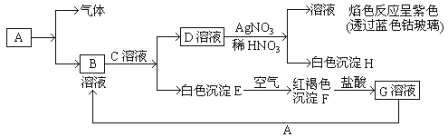
(1)写出B的化学式_____________________D的化学式________________。
(2)写出由E转变成F的化学方程式_____________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式____________________________;向G溶液加入A的有关离子反应方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应的说法,正确的是( )
A.物质失去的电子数越多,其还原性越强
B.物质所含元素化合价升高的反应叫还原反应
C.某元素由化合态变为游离态,则它一定被还原
D.置换反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 红棕色的NO2,加压后颜色先变深后变浅,但比原来要深
C. 500℃时比室温更利于合成氨
D. 用排饱和食盐水法收集Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl 极易溶于水,工业上用 HCl 气体溶于水的方法制取盐酸。
(1)用 12.0mol/L 浓盐酸配置 230mL 0.3mol/L 的稀盐酸,需要量取浓盐酸的体积为___mL;
(2)溶液稀释过程中需要的玻璃仪器有烧杯、玻璃棒、量筒、____________、___________;
(3)溶液稀释过程中有以下操作:
a.量取浓盐酸和一定体积的水,在烧杯中稀释
b.计算所需浓盐酸的体积
c.上下颠倒摇匀
d.加蒸馏水至刻度线 1-2cm 地方,改用胶头滴管加蒸馏水至凹液面与刻度线相切
e.将稀释液转移入容量瓶,洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶,振荡
以上正确的操作顺序为____________________________________________(填序号);
(4)实验过程中的以下操作会导致最终所配溶液浓度(填“偏大”、“偏小”或“不变”)
a.量取浓盐酸时俯视:______________________;
b.量取浓盐酸后,清洗了量筒并将洗涤液转移入容量瓶:______________________;
c.实验前,容量瓶中有少量残留蒸馏水:______________________;
(5)标准状况,1L 水中通入 aL HCl 气体,忽略盐酸溶液中 HCl 的挥发,得到的盐酸溶液密度为 b g/mL,物质的量浓度为 ______________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B |
装 置 图 |
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 |
选项 | C | D |
装 置 图 |
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①写出Na2O2作供氧剂的化学反应方程式____________;
②使酚酞溶液变红是因为________,红色褪去的可能原因是___________;
③加入MnO2反应的化学方程式为____________;
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行加下实验,实验步骤和现象如下:
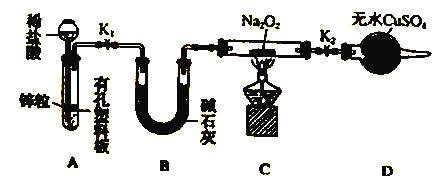
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后没有任何现象。
步骤3: ,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是______,B装置的作用_________。
②步骤3在点燃C处酒精灯前必须进行的操作是______________;
③装置D的目的是_________;
④你得到的结论是________(若能反应请用化学方程式表示);
⑤该实验设计中存在着明显不足之处,应该如何改进:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B. 金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C. 分子晶体的熔沸点低,常温下均呈液态或气态
D. 原子晶体中的各相邻原子都以共价键相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com