
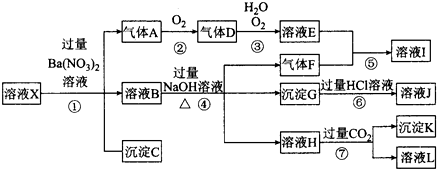
分析 某强酸性溶液X,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液和硝酸钡溶液反应生成沉淀C,则溶液呈存在SO42-,不存在和硫酸根离子反应的Ba2+,C是BaSO4;
酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,A是NO;
溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,产生沉淀,则溶液中存在Fe3+,沉淀G是Fe(OH)3,氢氧化铁和盐酸反应生成FeCl3,则J是FeCl3,溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+,沉淀K是Al(OH)3,溶液L是NaHCO3;
A是NO,则D是NO2,二氧化氮化和水反应生成硝酸和NO,则E是HNO3,硝酸和氨气反应生成硝酸铵,则I是NH4NO3.
解答 解:强酸性溶液X,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液和硝酸钡溶液反应生成沉淀C,则溶液呈存在SO42-,不存在和硫酸根离子反应的Ba2+,C是BaSO4;
酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,A是NO;
溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,产生沉淀,则溶液中存在Fe3+,沉淀G是Fe(OH)3,氢氧化铁和盐酸反应生成FeCl3,则J是FeCl3,溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+,沉淀K是Al(OH)3,溶液L是NaHCO3;
A是NO,则D是NO2,二氧化氮化和水反应生成硝酸和NO,则E是HNO3,硝酸和氨气反应生成硝酸铵,则I是NH4NO 3,
(1)K是Al(OH)3,由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32-、SiO32-,故答案为:Al(OH)3;CO32-、SiO32-;
(2)强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3-,故选b;
(3)亚铁离子和硝酸反应生成铁离子、一氧化氮和水,离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)转化⑥发生反应的现象为红褐色沉淀溶解,溶液变黄色,故答案为:红褐色沉淀溶解,溶液变黄色;
(5)铝离子和过量氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(6)若转化③中,NO2、H2O、O2三种物质恰好发生化合反应生成HNO3,该反应方程式为4NO2+2H2O+O2=4HNO3,则反应中D与O2的物质的量之比为4:1,故答案为:4:1;
(7)溶液中铁离子是否存在不能确定,铁离子和硫氰化钾溶液反应生成血红色溶液,所以可以用硫氰化钾溶液检验,故选②.
点评 本题考查了离子的推断,根据物质间发生反应的特殊现象结合离子共存来分析解答,熟悉物质的性质是解本题关键,根据溶液和硝酸钡反应生成气体确定溶液中存在亚铁离子,为解答本题的易错点,熟练掌握离子共存的条件,灵活运用知识解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1氨水中的NH4+ | |
| B. | 0.1mol Na2O2 所含的阴离子 | |
| C. | 12.5mL 16 mol•L-1的浓硫酸能溶解的Cu | |
| D. | 18g H2O中含NA个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②④ | C. | ①②③ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片跟氢氧化钠溶液反应:Al+4OH-═[Al(OH)4]-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
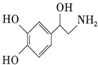
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 去甲肾上腺素属于氨基酸 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com