
 .
.  天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.③④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子核外电子有六种运动状态 | B. | NH4+ 中N原子轨道杂化类型为sp3 | ||
| C. | 电负性:O>Cl | D. | 第一电离能 Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )| A. | 该电池的反应方程式为I2+2Ag═2AgI | |
| B. | 石墨电极为正极,银电极为负极 | |
| C. | 正极的电极反应是:Ag-e-═Ag+ | |
| D. | 装置中电子移动的途径是:银电极→导线→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在周期表中,主族元素的主族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强 | |
| C. | 同主族元素随着原子的核电荷数的递增,原子半径依次增大 | |
| D. | 主族元素的单质,随相对分子质量的增大,熔、沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 和
和 .甲烷和庚烷
.甲烷和庚烷查看答案和解析>>
科目:高中化学 来源: 题型:填空题
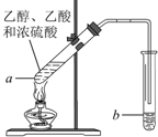 实验室制乙酸乙酯的主要装置如图所示,主要步骤为:
实验室制乙酸乙酯的主要装置如图所示,主要步骤为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com