
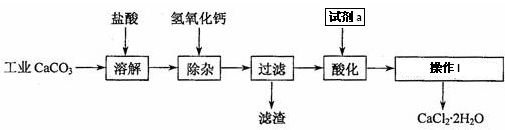
分析 工业碳酸钙加入盐酸可完全溶解生成氯化钙、氯化铁以及氯化钠等,加入氢氧化钙溶液,以除去溶液中少量的Fe3+,然后在酸性条件下蒸发结晶可得到CaCl2•2H2O,
(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳;加入氢氧化钙生成氢氧化铁沉淀;
(2)加入过量盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解;
(3)氯化钙溶液获得氯化钙晶体的方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(4)①根据氯元素守恒,得到氯化钙和硝酸银之间的关系式:2Ag+~2Cl-~CaCl2•2H2O,代入数据计算即可;
②样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大;
解答 解:工业碳酸钙加入盐酸可完全溶解生成氯化钙、氯化铁以及氯化钠等,加入氢氧化钙溶液,以除去溶液中少量的Fe3+,然后在酸性条件下蒸发结晶可得到CaCl2•2H2O,
(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
加入氢氧化钙溶液Fe3+沉淀完全,形成氢氧化铁沉淀,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓;
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;Fe3++3OH-=Fe(OH)3↓;
(2)因除去铁离子需加入过量的氢氧化钙,加入稀盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解且不引入新的杂质,
故答案为:稀盐酸;除去Ca(OH)2杂质;
(3)氯化钙溶液获得氯化钙晶体的方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥,
故答案为:蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(4)①设样品中含CaCl2•2H2O为x mol.
由关系式:2Ag+~2Cl-~CaCl2•2H2O
2 1
10-3mol $\frac{25}{250}$×x mol
解得x=5×10-3mol
w(CaCl2•2H2O)=$\frac{5×10{\;}^{-3}mol×147g/mol}{0.7500g}$=98.0%,
故答案为:98.0%;
②样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大,
故答案为:样品中存在少量的NaCl;少量的CaCl2.2H2O失水.
点评 本题考查了制备实验方案的设计,为高频考点,侧重于学生的分析、实验和计算能力的考查,计算时注意关系式的利用,注意的是从250mL中取25mL,所以在计算时要注意这一点,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 碳棒上有气体放出,溶液酸性变弱 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电流从a极到b极 | |
| D. | a极上发生了还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
| 苯胺 | 对氨基苯磺酸 | |
| 熔点 | -6.3℃ | 288℃ |
| 沸点 | 184℃ | (300℃开始分解炭化) |
| 水溶性 | 微溶于水 | 微溶于冷水、溶于热水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
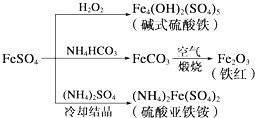
| A. | 制备碱式硫酸铁利用了过氧化氢的氧化性 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题:
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 分子中含有3种官能团 | |
| B. | 易溶于苯,难溶于水 | |
| C. | 可与NaOH溶液发生水解反应 | |
| D. | 其同分异构体不可能有芳香族化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com