

分析 (1)①电解质是在水溶液中或熔融状态下能导电的化合物;
②含有钠元素的化合物称为钠的化合物;
③氧化物由两种元素组成,其中一种是氧元素的化合物;
④盐是阳离子是金属离子或铵根离子,阴离子是酸根离子的化合物;
(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
②胶体有丁达尔效应:用一束光线照射,能产生一条光亮的通路;
③胶体遇电解质发生聚沉,生成的Fe(OH)3沉淀能与碘化氢发生中和反应.
解答 解:(1)①电解质是在水溶液中或熔融状态下能导电的化合物,电解质包括酸、碱、盐、金属氧化物和水,故H2、CO2不是电解质,
故答案为:A;
②含有钠元素的化合物称为钠的化合物,故Na2O、NaCl为钠的化合物,
故答案为:C;
③两种元素组成,其中一种是氧元素的化合物,CO2、Na2O为氧化物,
故答案为:B;
④盐是阳离子是金属离子或铵根离子,阴离子是酸根离子的化合物,故NaCl、FeCl3为盐,
故答案为:D;
(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
②溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,
故答案为:若该分散系能产生丁达尔效应,则制备成功;否则,不成功;
③a、加入电解质后,Fe(OH)3胶体发生聚沉,电解质溶液氢碘酸使Fe(OH)3胶体发生聚沉,产生Fe(OH)3沉淀;
故答案为:电解质溶液氢碘酸使Fe(OH)3胶体发生聚沉,产生Fe(OH)3沉淀;
b、随后沉淀溶解,溶液呈黄色,这是氢氧化铁被HI溶解所致,发生氧化还原反应,此反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++I2+3H2O,
故答案为:2Fe(OH)3+2I-+6H+=2Fe2++I2+3H2O.
点评 本题考查胶体的性质和离子方程式的书写,题目难度中等,注意HI既有酸性又有强还原性,I-能使Fe(OH)3胶粒聚沉,H+使其溶解.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
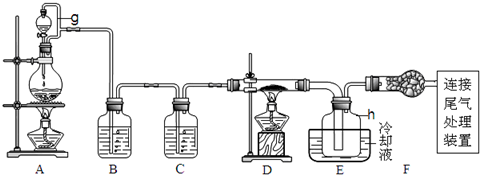
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | - | 315 | - |
| 熔点/℃ | -70.0 | - | - | - |
| 升华温度/℃ | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤(不要求写出具体操作过程) | 与其的实验现象和结论 |
| 将所得沉淀过滤、洗涤… | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,假如足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 淀粉通过下列转化可以得到多种有机物
淀粉通过下列转化可以得到多种有机物查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
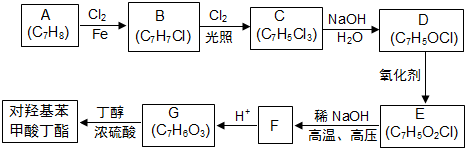
 ; F的分子式为C7H4O3Na2;
; F的分子式为C7H4O3Na2; ,该反应类型为取代反应;
,该反应类型为取代反应;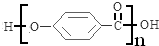 .
.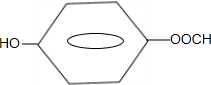 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com