
| A. | 相同温度下,Ksp(AgI)>Ksp(AgCl) | |
| B. | 由于AgCl与AgI的饱和水溶液几乎都不导电说明这两种物质均为非电解质 | |
| C. | 分别用等体积的蒸馏水和0.01 mol/L KI溶液洗涤AgI沉淀,用水洗涤沉淀损失量大 | |
| D. | 将AgCl与AgI的饱和溶液等体积混合后,再加入足量浓AgNO3溶液,只有AgI沉淀生成 |
分析 常温下向AgCl饱和溶液中滴加一定浓度的KI溶液,可观察到白色沉淀逐渐变成黄色,可说明AgI更易难溶于水,结合溶解平衡的影响因素解答该题.
解答 解:A.常温下向AgCl饱和溶液中滴加一定浓度的KI溶液,生成AgI,可说明Ksp(AgI)<Ksp(AgCl),故A错误;
B.AgCl与AgI的饱和水溶液几乎都不导电是因为溶解度较小,二者属于电解质,故B错误;
C.0.01 mol/L KI溶液洗涤AgI沉淀,碘离子浓度较大,可抑制AgI的溶解,则用水洗涤沉淀损失量大,故C正确;
D.如能满足Qc>Ksp,则都可生成沉淀,故D错误.
故选C.
点评 本题考查了沉淀溶解平衡的分析应用,为高频考点,侧重考查学生的分析能力,注意把握沉淀转化的原理的分析判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 石墨转化成金刚石的反应是吸热反应 | |
| C. | △H3=△H1-△H2 | |
| D. | △H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .正常条件下,pH值小于5.6的降雨是“酸雨” | |
| B. | 冰岛火山喷发含有大量SO2,在局部区域形成酸雨 | |
| C. | 全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害 | |
| D. | 汽车尾气含有氮氧化合物,过量排放形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
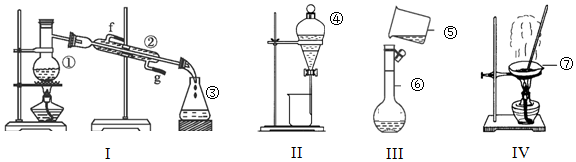
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com