
(18��)��A��B��C��D��E��F�Ƕ�����Ԫ����ɵ���ѧ���������ʣ����ǵ�ת����ϵ��ͼ��ʾ(���ַ�Ӧ������ȥ)��
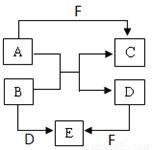
��1��������ת�����Ƿ�������ԭ��Ӧ��B��D��E����ͬ�ֽ���Ԫ�أ�FΪǿ����ֲ�����ȥ��
��B+D��E�����ӷ���ʽΪ ��CΪͬ����Ԫ�ع��ɵ�1��1�ͻ������C�ĵ���ʽΪ ��
��2����A��D��FΪ���ʣ�B��C��EΪ�����BΪ���ַǽ���Ԫ������ɵĻ������E�Ļ�ѧʽΪ ��A+B��C+D�Ļ�ѧ����ʽΪ ��
�ס��Ҷ��Ƕ�Ԫ���廯�����32g�ķ�ĩ��������Ũ���Ტ���ȣ���ȫ�ܽ����ɫ��Һ�������Һ�м�������Ba(NO3)2��Һ�����ˡ�ϴ�ӡ�����ó���46.6g����Һ���ٵμ�NaOH��Һ���ֳ�����ɫ������
���ҵĿ�ʯ��Ȼ���д����϶࣬��ȡһ�����ң�����ϡ����ʹ��ȫ���ܽ⣬��Һ��ΪA��B���ȷݣ���A�м�����������������Һ�����ˡ�ϴ�ӡ����յú���ɫ����28g���������������ɫ��������Ԫ����ͬ����B�м���8.0gͭ�۳�ַ�Ӧ����ˡ�ϴ�ӡ������ʣ�����1.6g��
��1��д�����ɼ������ӵĽṹʾ��ͼ ��32g��������Ũ�����з�Ӧת�Ƶĵ�����Ϊ ���������������г�����յĻ�ѧ����ʽΪ ��
��2���ҵĻ�ѧʽ ��ϡ�����ܽ��ҵĻ�ѧ����ʽΪ ��
��3�����������������г�����յ��������ͨ��һ����A��Һ�У��÷�Ӧ�����ӷ���ʽΪ �����ʵ��֤���˲���Ӧ�����Һ�н���Ԫ�صĻ��ϼ� ��
(18��)
��1��Al3++3AlO2- +6H2O��4Al(OH)3�� ��2�֣� 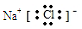 ��1�֣�
��1�֣�
��2��CO��1�֣� 2Mg + CO2  2MgO + C��2�֣������������۷֣�������д����1�֣�
2MgO + C��2�֣������������۷֣�������д����1�֣�
��1��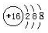 ��1�֣� 2NA��1�֣�
��1�֣� 2NA��1�֣�
Cu2S+ 2O2 2CuO+SO2��2�֣�
2CuO+SO2��2�֣�
��2��Fe7O9 ��3FeO��2Fe2O3��2�֣� 9H2SO4+Fe7O9��3FeSO4+2Fe2(SO4)3+9 H2O ��2�֣�
��3��SO2+2Fe3++2H2O��2Fe2++SO42-+4H+��2�֣�������ʽ�����ӷ��Ŵ�����ƽ�������֣�
ȡ��Ӧ�����Һ�������Թ��У���һ���м����ữ��KMnO4��Һ������ɫ����ԭ��+2����������һ���м���KSCN��Һ��������Ѫ��ɫ��Һ����ԭ��+3������2�֣�������������Ҳ�ɣ�
��������
���������I����1��F��ǿ�B��D��E�к���ͬ�ֽ���Ԫ�أ����жϸý���Ԫ����Al��D�����Σ����������Ʒ�Ӧ������������������BΪƫ�����Σ���������ƫ��������ӷ���˫ˮ�ⷴӦҲ����������������������B +D��E�����ӷ���ʽΪAl3++3AlO2- +6H2O��4Al(OH)3����CΪͬ����Ԫ�ع��ɵ�1��1�ͻ����A��ǿ�Ӧ����C��A��ƫ�����Ʒ�Ӧ�����Ȼ�������A�����ᣬ���������Ʒ�Ӧ����ˮ���Ȼ��ƣ�Cl��Na��ͬ����Ԫ�أ���ԭ�Ӹ�������1:1,����C��NaCl��Ϊ���ӻ���������ʽ��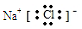 ��
��
��2��A+B��C+D�ķ�Ӧ���û���Ӧ����B����2�ַǽ�����ɵĻ������B��CO2��A��Mg�����߷�Ӧ����C��MgO����D��C���ʣ�������̼��C���ʸ��·�Ӧ����CO������E��CO��A +B��C+D�Ļ�ѧ����ʽΪ2Mg + CO2  2MgO + C��
2MgO + C��
II����1����ɫ��Һ�к���ͭ���ӣ�����к���CuԪ�أ������ᱵ��Һ��Ӧ������ɫ��������ó���Ϊ���ᱵ��˵��������к���SԪ�أ�46.6g���ᱵ�����ʵ�����0.2mol��˵��32g����SԪ�ص�������6.4g����CuԪ�ص�������32��604=25.6g��CuԪ�ص����ʵ�����0.4mol�������Cu��SԪ�ص����ʵ���֮����0.4:0.2=2:1�������Cu2S������������S2-�����ӽṹʾ��ͼΪ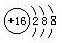 ��32g�����ʵ�����0.2mol��CuԪ�ش�+1�����ߵ�+2�ۣ���������2�ۣ�SԪ�ش�-2�����ߵ�+6�ۣ�����8�ۣ����Թ�ʧȥ10�����ӣ���0.2mol�ײμӷ�Ӧת�Ƶĵ�������2NA������ͭ��������ȫ��Ӧ���ɶ��������CuO����ѧ����ʽ��Cu2S+ 2O2
��32g�����ʵ�����0.2mol��CuԪ�ش�+1�����ߵ�+2�ۣ���������2�ۣ�SԪ�ش�-2�����ߵ�+6�ۣ�����8�ۣ����Թ�ʧȥ10�����ӣ���0.2mol�ײμӷ�Ӧת�Ƶĵ�������2NA������ͭ��������ȫ��Ӧ���ɶ��������CuO����ѧ����ʽ��Cu2S+ 2O2 2CuO+SO2��
2CuO+SO2��
��2���������֪������ɫ����ΪFe2O3�������ʵ�����28g/160g/mol=0.175mol����FeԪ�ص����ʵ�����0.35mol��˵�����к���Fe��OԪ�أ���B�м���8.0gͭ�۳�ַ�Ӧ����ˡ�ϴ�ӡ������ʣ�����1.6g������������Cu������Ӧ����ѧ����ʽ��2Fe3++Cu=2Fe2++Cu2+���μӷ�Ӧ��Cu��������8.0-1.6=6.4g�����ʵ�����0.1mol����B��Һ�������ӵ����ʵ�����0.2mol��A��B�ǵ����ģ������������ӵ����ʵ�����0.35mol-0.2mol=0.15mol��������+3������+2���������ʵ���֮����0.2:0.15=4:3�����ҵĻ�ѧʽ��Fe7O9 ��3FeO��2Fe2O3�� 3FeO��2Fe2O3��ϡ���ᷴӦ����������������������ˮ����ѧ����ʽ��9H2SO4+Fe7O9��3FeSO4+2Fe2(SO4)3+9 H2O��
��3������������Ӧ����������Ƕ�������A�к��������Ӻ�Һ̬���ӣ����Զ��������������ӷ���������ԭ��Ӧ������������Ӻ��������ӣ����ݵ���غ㣬����ˮ�μӣ������������������ɣ����ӷ���ʽ��SO2+2Fe3++2H2O��2Fe2++SO42-+4H+���ò���Ӧ����Һ�н������ӵĻ��ϼ�ӦΪ+2�ۣ��������������ӵĻ�ԭ�������顣�����������ӿ���KSCN��Һ�����顣����������£�ȡ��Ӧ�����Һ�������Թ��У���һ���м����ữ��KMnO4��Һ������ɫ����ԭ��+2����������һ���м���KSCN��Һ��������Ѫ��ɫ��Һ����ԭ��+3����
���㣺�������ʵ��ƶϣ��������ʵ�Ӧ�ã����ӵļ��飬��ѧʽ�ļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����������ȷ����
A��CO2ͨ������Թ�����������������������Թ�������Դ���̼��
B��һ������ѱ�����ΪNa2O���ƿ�10.8g������Ͷ��100gˮ�У�����H2 0.2g��������������4.6g
C�����������ã����������������ױ���ʴ
D��������ˮPH����7�������PHС��5.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��15�֣��붼����ĸ�����д����ѡ����ѡ�����÷֣������м��־��壺
A��SiC
B��CO2
C��ˮ��
D������
E�������
F���Ȼ��
G�����ʯ
H����
��1�����о���������������ͷ����
��2������ԭ�Ӿ���Ļ�������________________________
��3�����й��ۼ������Ӿ�����_________________________
��4�������ۻ���ѧ���������仯����_________________
��5������״̬���ܵ������___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ����3�½β������ۻ�ѧ�Ծ��������棩 ���ͣ������
(14��)�״���һ����Ҫ�Ļ���ԭ�ϣ���������������Ҫ��Ӧ�á���ҵ������Ȼ��Ϊԭ�ϣ���Ϊ�����Ʊ��״���
��i���Ʊ��ϳ�����CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 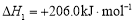
��ii���ϳɼ״���CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 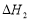
��ش��������⣺
��1���Ʊ��ϳ�������1.0mol CH4��2.0mol H2O(g)ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��i����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
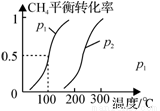
����֪100��ʱ�ﵽƽ���ʱ��Ϊ5min����ӷ�Ӧ��ʼ��ƽ�⣬��������ʾ��ƽ����Ӧ����Ϊ��v(H2) = ��
��ͼ��p1 p2���<��������>����=������
��Ϊ����ϳ�����H2������CO��������⣬ԭ������������CO2��������Ӧ���£�
CO2(g)+H2(g) CO(g)+H2O(g)��Ϊ��ʹ�ϳ��������ѣ�������ԭ�����м����������̼�����Ϊ ��
CO(g)+H2O(g)��Ϊ��ʹ�ϳ��������ѣ�������ԭ�����м����������̼�����Ϊ ��
��2���ϳɼ״�����Cu2O/ZnO�������������£���2L���ܱ�������ͨ��1mol CO(g)��2mol H2(g)��������Ӧ(ii)����Ӧ�����У�CH3OH�����ʵ�����n����ʱ�䣨t�����¶ȵĹ�ϵ��ͼ��ʾ��
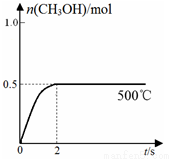
�ٷ�Ӧ��ii������ ������¡����¡��������Է����С�
�ھ��о�����Ӧ������������õ�ΪCu2O����Ӧ��ϵ�к�������CO2 ������ά��Cu2O�������䣬
ԭ���� ���û�ѧ����ʽ��ʾ����
����500���ѹ�����£�������ͼ�л�����Ӧ��ϵ��n(CH3OH)��ʱ��t�仯��������ͼ��
��3����ҵ�Ͽ�ͨ���״��ʻ�������ȡ����������䷴Ӧ���Ȼ�ѧ����ʽΪ��
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ��������Ա�Ը÷�Ӧ�������о��������о�������£�
��������Ա�Ը÷�Ӧ�������о��������о�������£�
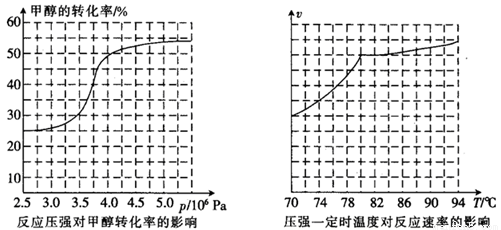
�ٴӷ�Ӧѹǿ�Լ״�ת���ʵ�Ӱ�조Ч�ʡ�������ҵ��ȡ�������Ӧѡ���ѹǿ�� �� (�3.5��106Pa������4.0��106Pa����5.0��106Pa��)��
��ʵ�ʹ�ҵ�����в��õ��¶���80�棬�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ����3�½β������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е�λ����ͼ��ʾ������XԪ��ԭ�����������������ڲ��������3����������˵����ȷ����
X | Y | ||
Z | W | Q |
A��X��W�������γ�Ħ��������ͬ�Ļ������������������Ϊ1��2
B����X��ZԪ�صij���������Ϊ���Ӿ���
C���������Ӧ��ˮ�������ԣ�W��Q
D��ԭ�Ӱ뾶��С��ϵ��Q>W>Z>Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����и���һģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����ԭ��Ⱦ�ϵ����Ľṹ��ʽΪ��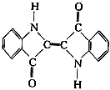 �����ķ���ʽ�ǣ�C16H10N2O2
�����ķ���ʽ�ǣ�C16H10N2O2
B���ṹΪ����CH��CH��CH��CH��CH��CH��CH��CH�����ĸ߷��ӻ�����䵥������ϩ
C��������һ��ʱ����Ȳ����ȩ���۰�ʲô������ϣ���ȫȼ������������������CO2������
D����ϩ�ᣨCH2=CHCOOH����ɽ���ᣨCH3CH=CHCH=CHCOOH������ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��ұ�и�����ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ������
��15�֣��о�̼���仯��������Ҫ���塣
��1����ѧ����CO2��H2�����״���ȼ�ϡ�
��֪���״���ȼ���Ȧ�H= -726.5kJ/mol��������ȼ���Ȧ�H= -285.8kJ/mol��
���³�ѹ�£�CO2(g)��H2(g)��Ӧ����CH3OH(l)���Ȼ�ѧ����ʽ ��
��2��460��ʱ����4L�ܱ������г���1mol CO2��3.25mol H2����һ�������·�Ӧ�����CO2��CH3OH(g)�����ʵ�����ʱ��ı仯��ϵ��ͼ��ʾ��
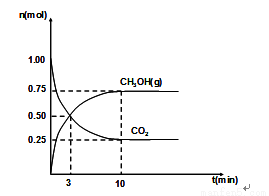
�ٴӷ�Ӧ��ʼ��3minʱ��H2O(g)��ƽ����Ӧ���� ��
�����д�ʩ�м��ܼӿ췴Ӧ��������ʹH2��ת����������� ��
A��ʹ�ø���Ч�Ĵ���
B����ԭ�������ٳ���1mol CO2
C����ԭ�������ٳ���1mol He
D�������������
E�����״���ʱ�������
�����÷�Ӧ���ʱ�Ϊ��H��������ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________��
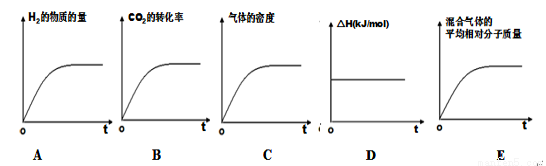
�ܸ������£��˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ ��
��3����ѧ���о����֣��������õ������CO2��ԭΪ̼�⻯���ԭ������ͼ��ʾ���������Һ��һ�ּ��Σ�����CxHyΪC2H4�����ԭ�����ܷ�ӦʽΪΪ�� ��
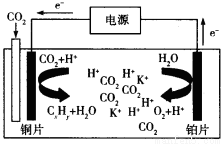
��4����֪
��ѧʽ | ����ƽ�ⳣ�� |
HCN | K=4.9��10-10 |
H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
��25��ʱ�����HCN��NaCN�Ļ����Һ��pH=11����c(HCN)/c(CN-)=_________��
����NaCN��Һ��ͨ������CO2��������Ӧ�����ӷ���ʽΪ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ������ѧ�ڵ�һ���¿������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�����͵��Ҵ���أ����û����������ܼ�������ܷ�ӦΪ��C2H5OH +3O2 �� 2CO2 +3H2O,���ʾ����ͼ,����˵����ȷ����
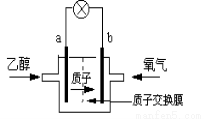
A��a��Ϊ��ص�����
B����ع���ʱ������a���ص��߾������ٵ�b��
C����ظ����ĵ缫��ӦΪ��4H+ + O2 + 4e�� = 2H2O
D����ع���ʱ,1mol�Ҵ�������ʱ����12mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡȪ���и���3�½�ѧ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������Ӻ�ˮ�л�õ���
A������ B���Ȼ�þ C���� D����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com