
����Ŀ����������ȼ���е�H2S�������ɼ��ٶԴ�������Ⱦ�����ɽ�����Դ�����á��ش��������⣺
��1��H2S��S��ȼ���������ʾ��
���� | ȼ����/��H��kJmol-1�� |
H2S | -a |
S | -b |



��д��������H2S��SO2��Ӧ���Ȼ�ѧ����ʽ______��
��2������H2S���Ϊһ��ȼ�ϵ�أ�ԭ����ͼa��ʾ�����У�Fe2+�ڵ�ع����е�������______����д�� I�ҷ��������ӷ���ʽ______��
��3��Ϊ̽��H2S��ֱ���Ƚ�2H2S��g��=2H2��g ��+S2��g������һ���Ϊ2L���ܱ������г���2 mol H2S��1 molAr ����ϡ�����ã�������ʵ�顣
��ijͬѧ�����ͬ�¶���H2S�����ʵ����뷴Ӧʱ���ͼ��ͼb�ǽ�ȡ��ͼ����м�ij���֡������T2�¶��£�0-l0s�ڣ�H2S�ķ�Ӧ����v=______moL-1s-1��
��ͼb�У�T1��T2��T3�����¶ȣ���ߵ���______���Ƚ�A����B����淴Ӧ���ʵĴ�С��vA���棩______vB���棩����������������������=������
��ͼc�DZ�ʾ��Ӧ2H2S��g��=2H2��g��+S2��g��ƽ��ʱ��װ���ڸ�����������ʵ�������=���¶ȵĹ�ϵ������Ar����仯����δ������������㣺C���ƽ�ⳣ��K=______��D��ƽ��ʱ��H2S��ת����=______��
���𰸡�2H2S��g��+SO2��g��=3S��s��+2H2O��l����H=��-2a+3b��kJ/mol ���� 2Fe3++H2S=2Fe2++2H++S�� 0.04 T3 �� 0.25 66.7%
��������
��H2S��ȼ���Ȼ�ѧ����ʽ��H2S(g) +![]() O2(g)=SO2(g)+H2O(l) ��H= ��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�������Ȼ�ѧ����ʽ�Ƶ�����Ӧ���ٸ��ݸ�˹��������H��
O2(g)=SO2(g)+H2O(l) ��H= ��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�������Ȼ�ѧ����ʽ�Ƶ�����Ӧ���ٸ��ݸ�˹��������H��
��Fe2+�ڵ���г���ѭ�������ݴ����ص��жϣ�I��Fe3+��H2S����ΪS���ݴ���д����ʽ��
�Ǣٷ�Ӧ����Ϊ��λʱ����Ũ�ȵı仯��������ͼ��ʣ��1.2mol H2S�������ʼ�����ɼ���H2S�ķ�Ӧ���ʣ��ڸ������ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ߣ�����¶ȶԷ�Ӧ���ʵ�Ӱ�죬�¶�Խ�ߣ���Ӧ����Խ�ߣ�����֪H2S��ʼ����������仯��Ϊxmol���г�����ʽ���ڸ��ݲ�ͬ�����²�ͬ�������ʵ����Ĺ�ϵ���x��������C���ƽ�ⳣ��K��H2S��ת���ʡ�
��H2S��ȼ���Ȼ�ѧ����ʽ��H2S(g) +![]() O2(g)=SO2(g)+H2O(l) ��H=��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�����ݸ�˹���ɣ�H2S��SO2��Ӧ���Ȼ�ѧ����ʽΪ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1���ʴ�Ϊ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1��
O2(g)=SO2(g)+H2O(l) ��H=��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�����ݸ�˹���ɣ�H2S��SO2��Ӧ���Ȼ�ѧ����ʽΪ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1���ʴ�Ϊ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1��
��Fe2+�ڵ�ع����й�����ѭ�����ã���������û�иı䣬����Fe2+Ϊ������I�ҷ����ķ�ӦΪFe3+����H2S�����ӷ���ʽΪ��2Fe3++H2S=2Fe2++2H++S�����ʴ�Ϊ��2Fe3++H2S= 2Fe2++2H++S����
�Ǣ���ʼʱ����2molH2S������ͼ���֪10sʱʣ��1.2molH2S����![]() ���ʴ�Ϊ��0.04��
���ʴ�Ϊ��0.04��
�ڸ��ݷֽⷴӦһ��Ϊ���ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ߣ���T3�¶���ߣ�A����B������Ӧ�ĸ�����Ũ�Ⱦ���ͬ����A���Ӧ��T3��ߣ���Ӧ������Խϸߣ�����vA(��)��vB(��)���ʴ�Ϊ��T3������
��������ʼʱ2 molH2S����H2S�仯��Ϊxmol��������ʽ��

C��ʱ��ƽ��ʱH2S��H2�����ʵ���������ͬ����ƽ��ʱH2S��H2�����ʵ�����ͬ����2-2x=2x��x=0.5����ƽ��ʱc(H2S) = 0.5molL-1��c(H2)=0.5 molL-1��c(S2)=0.25 molL-1��ƽ�ⳣ��![]() ��D��ʱ��ƽ��ʱS2��H2S�����ʵ���������ͬ����ƽ��ʱS2��H2S�����ʵ�����ͬ����2-2x=x�����x=
��D��ʱ��ƽ��ʱS2��H2S�����ʵ���������ͬ����ƽ��ʱS2��H2S�����ʵ�����ͬ����2-2x=x�����x= ![]() ��H2S��ת����
��H2S��ת���� ���ʴ�Ϊ��0.25��66.7%��
���ʴ�Ϊ��0.25��66.7%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬŨ�ȣ�c)���¶ȣ�T)������������ˮ���˲ʱ���ʣ�v�����±��������жϲ���ȷ����
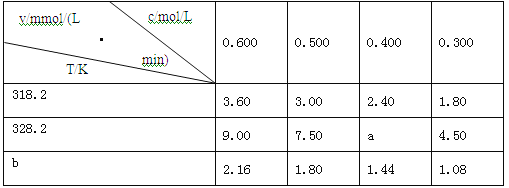
A��a=6.00
B��ͬʱ�ı䷴Ӧ�¶Ⱥ����ǵ�Ũ�ȣ�v���ܲ���
C��b��318.2
D����ͬ�¶�ʱ������Ũ�ȼ���һ�������ʱ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۷�����PAR���Ƿ��������ϴ��б��������������ֹ������ϣ��ں��պ����������й㷺Ӧ�á���ͼ�������������ᣨ![]() ���ϳɾ۷���E��·�ߣ�
���ϳɾ۷���E��·�ߣ�
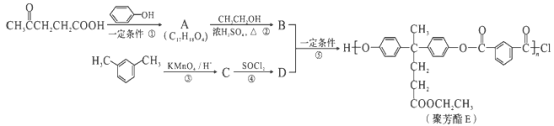
��֪����![]()
��![]() ��R��R����ʾ������
��R��R����ʾ������
��1�����������к��еĹ��������ʻ���_______������������ƣ���
��2��D�Ľṹ��ʽΪ_______��
��3�����й����л���B��˵����ȷ����_________������ĸ���ţ���
a���ܷ���ȡ����Ӧ b������Ũ��ˮ��Ӧ
c���ܷ�����ȥ��Ӧ d������H2�����ӳɷ�Ӧ
��4��A��B�Ļ�ѧ����ʽΪ_________��
��5��C�ķ���ʽΪ_________����������������C��ͬ���칹����_________�֡�
���ܷ���������Ӧ
������NaHCO3��Һ��Ӧ
�۷������б�������������![]() �ṹ
�ṹ
������ͬ���칹���У���һ�ֱ�����������ȡ�����Һ˴Ź�������ͼ��4�ַ�����ʣ�д��������������NaOH��Һ���ȷ�Ӧ�Ļ�ѧ����ʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Լ�����������ӦΪ��2NO2(g)+O3(g)N2O5(g)+O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ����
A | B | C | D |
|
|
|
|
t1ʱ�����������ƽ�����������ƶ� | ��ƽ��ʱ�����ı�x����xΪc(O2) | �ӷ�Ӧ��ʼ��ƽ������Ũ�ȱ仯 | �����¶ȣ�ƽ�ⳣ����С |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol��L-1��HX��Һ��HY��Һ�зֱ�μ�ͬŨ�ȵ�NaOH��Һ����Ӧ����Һ��ˮ�����c��H������ʾΪpHˮ��-lgc��H����ˮ��pHˮ��μ�����������Һ����Ĺ�ϵ��ͼ��ʾ��
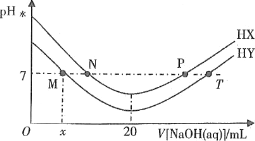
�����ƶ���ȷ����
A.HX�ĵ��뷽��ʽΪHX��H����X-
B.T��ʱc��Na������c��Y-����c��H������c��OH-��
C.������������ˮ�ֱ�ϡ��N��P����Һ��pH������
D.�����£�HY�ĵ��볣��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������Ӧ��X��g��+Y��g��2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������������˵����ȷ���ǣ�������
t�Mmin | 2 | 4 | 7 | 9 |
n��Y���Mmol | 0.12 | 0.11 | 0.10 | 0.10 |
A. ��Ӧǰ4min��ƽ����Ӧ��������Z��=0.0125molL-1min-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ�����棩����������
C. �����������䣬�ٳ���0.2molZ����ƽ��ʱX�������������
D. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ��ϳɰ��Ͱ���������������ͼ��
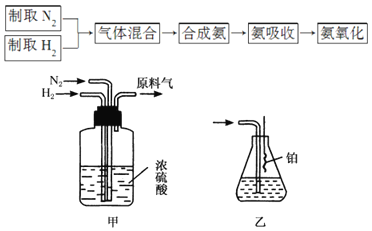
(1)NԪ�������ڱ���λ��______��
(2)����������ͨ����װ�ã���װ�õ����ó��˽������ϡ��������______���á�
(3)����װ������һ��ʱ�䰱����ͨ�������ͬʱ�������ȵIJ�˿������װ�õ���ƿ�ڣ���ʹ��˿���ֺ��ȣ���ƿ�л��ɹ۲쵽��������______��
(4)д����װ���а������Ļ�ѧ����ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100��ʱ����0.40 mol���������������һ��2 L��յ��ܱ������У�������Ӧ��2NO2 N2O4��ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ��±����ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
��1�������������£��ӷ�Ӧ��ʼ��20 sʱ����NO2��ʾ��ƽ����Ӧ����Ϊ__________mol��L1��s1��
��2��n3________(����>����<������=��)n4���÷�Ӧ��ƽ�ⳣ��K����ֵΪ___________(��ȷ��0.1)��
��3��������ͬ�����������������г���N2O4��Ҫ�ﵽ����ƽ��״̬��N2O4����ʼŨ����______mol��L1��
��4��������3���ﵽƽ���N2O4��ת����Ϊ______________����������ƽ��Ħ������Ϊ______________��
��5���ﵽƽ�����������¶ȣ�������ɫ�����������¶Ⱥ�Ӧ2NO2N2O4��ƽ�ⳣ����_______________(��������������С������������)��
��6���ﵽƽ����������ܱ��������ٳ���0.32 mol He�����������������Ϊ4 L����ƽ�⽫______________�����������ƶ����������ƶ����������ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʵ���Һ����NaCl ��NH4Cl ��Na2CO3 ��Al2(SO4)3 ��CH3COOH ��NaHCO3��
��1��25��ʱ��0.1mol��L-1����Һ��pH________7������>��������������<��������ԭ����_____________�������ӷ���ʽ��ʾ����
��2�������£�Ũ�Ⱦ�Ϊ0.1mol/L�Ģۺ͢���Һ����������________��������ͬ������������ͬ������
��3��������0.1 mol/L�Ģ���Һ��ˮϡ�����У����б���ʽ������һ��������_________��
A��c(H��) B��c(H+)/c(CH3COOH) C��c(H��)��c(OH��)
��4�������£�ʹ��pH�Ʋⶨ0.1 mol/LNH4Cl��Һ��pH=5.12���ɴ˿��Եõ��Ľ�����_______������ĸ����
a����Һ��c(H+)��c(OH��) b��NH4+ˮ��������
c��NH3��H2O������ d����H2O�������c(H+)��10-7 mol/L
e�����ʵ���Ũ����ȵİ�ˮ������������ϣ���ҺpH=7
��5��ij�¶��£���ͬ�������ͬpH�İ�ˮ������������Һ��ˮϡ��ʱ��pH�仯������ͼ��ʾ�������ж���ȷ����____��

A��a�㵼��������b��ǿ
B��b���KWֵ����c��
C����������ȫ��Ӧʱ�������������Va>Vc
D��a��c����c(H��)���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com