

分析 (1)若A为常见的金属单质,焰色反应呈黄色,则A为Na,Na和水反应生成NaOH和氢气,X能使品红溶液褪色,则X是SO2,C为NaOH,B为H2,D能和SO2反应,则D是Na2SO3、E是NaHSO3;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,A是Cl2,氯气和水反应生成HCl和HClO,C和X反应生成D、D能和X反应生成E,盐酸能和碳酸钠、亚硫酸钠反应且是两步反应;
(3)若A为淡黄色粉末,且能和水反应,则A为Na2O2,若X为一种造成温室效应的气体,X是CO2,过氧化钠和水反应生成NaOH和氧气,NaOH和CO2反应先生成Na2CO3,二氧化碳过量时生成NaHCO3;
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红,则D中含有铁离子,所以A为NO2,C为HNO3,B为NO,D为Fe(NO3)3、E为Fe(NO3)2,再结合题目分析解答.
解答 解:(1)若A为常见的金属单质,焰色反应呈黄色,则A为Na,Na和水反应生成NaOH和氢气,X能使品红溶液褪色,则X是SO2,C为NaOH,B为H2,D能和SO2反应,则D是Na2SO3、E是NaHSO3;
C是NaOH,E是亚硫酸氢钠,二者反应离子方程式为OH-+HSO3-=SO32-+H2O,
故答案为:OH-+HSO3-=SO32-+H2O;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,A是Cl2,氯气和水反应生成HCl和HClO,C和X反应生成D、D能和X反应生成E,盐酸能和碳酸钠、亚硫酸钠反应且是两步反应;
①组成单质A的元素Cl元素原子核外有3个电子层、最外层7个电子,所以在周期表中的位置为第三周期第VIIA族,故答案为:第三周期第VIIA族;
②通过以上分析知,X可能为Na2CO3、Na2SO3,故选bc;
(3)若A为淡黄色粉末,且能和水反应,则A为Na2O2,若X为一种造成温室效应的气体,X是CO2,过氧化钠和水反应生成NaOH和氧气,NaOH和CO2反应先生成Na2CO3,二氧化碳过量时生成NaHCO3;
①A和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应中过氧化钠是氧化剂和还原剂,该反应中转移的电子数目为2,则1molA与足量的H2O充分反应时转移的电子数目为 NA,
故答案为:NA;
②A中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,所以所含有的化学键类型为 离子键、共价键,故答案为:离子键、共价键;
③若X为一种造成温室效应的气体,D是碳酸钠、E是碳酸氢钠,可以用盐酸、氯化钡检验碳酸钠、碳酸氢钠,故选ab;
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红,则D中含有铁离子,所以A为NO2,C为HNO3,B为NO,D为Fe(NO3)3、E为Fe(NO3)2,
二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO.
点评 本题以Fe、Cl、Na元素及其化合物之间的转化为载体考查无机物推断,明确常见物质性质及物质之间的反应是解本题关键,利用物质特殊性进行推断,注意过氧化钠和水反应中转移电子的计算,为易错点.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①⑥ | C. | ①②⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
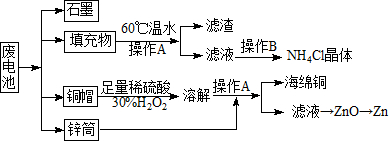 常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余NO | B. | 剩余O2 | C. | 剩余NO2 | D. | 不剩余气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
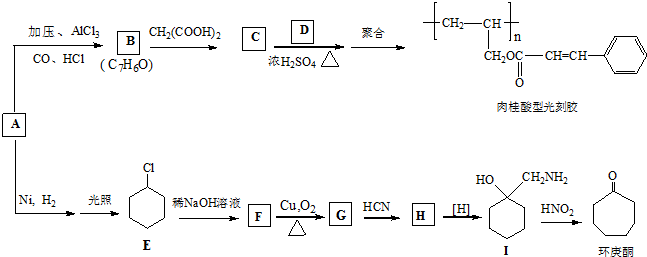
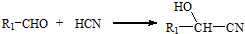
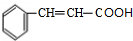 、CH2=CHCH2OH.
、CH2=CHCH2OH.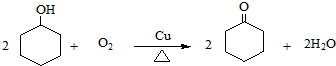 .
.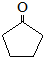 (环戊酮)为起始原料制备
(环戊酮)为起始原料制备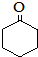 (环己酮)的合成路线.
(环己酮)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②③④ | C. | ②③④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com