
| A. | 检验溶液中I-:取样→滴加氯水→再滴加淀粉溶液,溶液变蓝 | |
| B. | 检验溶液中的Fe2+:取样$\stackrel{KSCN溶液}{→}$无明显现象$\stackrel{KMnO_{4}}{→}$红色溶液 | |
| C. | 证明氧化性Fe3+>Cu2+:向FeCl3、CuCl2混合液中加入少量铁粉,无红色固体产生 | |
| D. | 配制0.5mol•L-1的CuSO4溶液:用天平称取12.5g CuSO4•5H2O配成100mL溶液 |
分析 A.碘离子具有还原性,能被氯气氧化生成碘,碘能使淀粉试液变蓝色;
B.亚铁离子和KSCN溶液不反应,铁离子能使KSCN溶液变红色,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
C.向FeCl3、CuCl2混合溶液加铁粉,先发生Fe与铁离子的反应;
D.12.5g五水硫酸铜的物质的量=$\frac{12.5g}{250g/mol}$=0.05mol,配制成100mL溶液时,根据c=$\frac{n}{V}$计算.
解答 解:A.碘离子具有还原性,能被氯气氧化生成碘,碘能使淀粉试液变蓝色,该实验操作中能说明含有碘离子,故A正确;
B.亚铁离子和KSCN溶液不反应,铁离子能使KSCN溶液变红色,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,高锰酸钾溶液呈紫色、铁离子和KSCN溶液呈血红色,影响颜色变化,应该用氯水氧化亚铁离子,故B错误;
C.向FeCl3、CuCl2混合溶液加铁粉,先发生Fe与铁离子的反应生成亚铁离子,再发生Fe与氯化铜反应,则说明氧化性:Cu2+<Fe3+,故C正确;
D.12.5g五水硫酸铜的物质的量=$\frac{12.5g}{250g/mol}$=0.05mol,配制成100mL溶液时,根据c=$\frac{n}{V}$知,溶液的物质的量浓度的0.5mol/L,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及溶液配制、离子检验、氧化性强弱比较等知识点,明确实验原理及物质或离子性质是解本题关键,易错选项是B,注意高锰酸钾溶液颜色影响铁离子和KSCN溶液的反应,题目难度中等.


科目:高中化学 来源: 题型:解答题
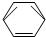 -CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH
-CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH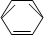 +HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O
+HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
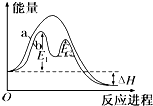
| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
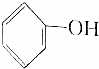 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )| A. | 2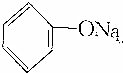 +H2O+CO2→2 +H2O+CO2→2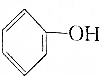 +Na2CO3 +Na2CO3 | B. | 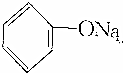 +H2O+CO2→ +H2O+CO2→ +NaHCO3 +NaHCO3 | ||
| C. |  +Na2CO3→ +Na2CO3→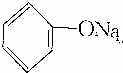 +NaHCO3 +NaHCO3 | D. | 2 +2Na→2 +2Na→2 +H2↑ +H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
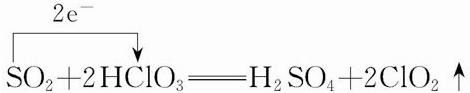 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
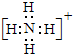
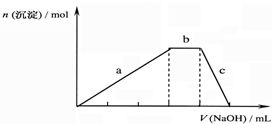
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
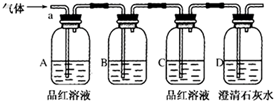
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com